
【题目】氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
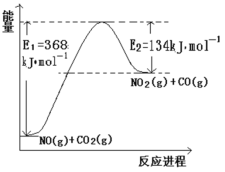
⑴根据下面能量变化示意图,请写出 NO 和 CO2反应的热化学方程式_________。
⑵在固定体积的密闭容器中,进行如下化学反应:2NH3(g)![]() N2(g)+3H2(g) △H>0,其平衡常数 K 与温度 T 的关系如下表:
N2(g)+3H2(g) △H>0,其平衡常数 K 与温度 T 的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K | 4.1×106 | K1 | K2 |
①试判断 K1_________K2(填写“>”,“<”或“=”);
②该反应的熵变S_________0(填 >、< 或 = )
③下列各项能说明该反应已达到平衡状态的是_________(填字母);
a.容器内N2、H2、NH3的物质的量之比为1∶3∶2 b.2υ(NH3)正 = 3υ(H2)逆
c.容器内混合气体平均相对分子质量保持不变 d.混合气体的密度保持不变
④一定温度下,在 1L 密闭容器中充入 1molN2和 3molH2 并发生反应。若容器容积恒定,10min 达到平衡时,气体的总物质的量为原来的9/10,则N2的转化率![]() (N2)=_________________
(N2)=_________________
⑶对反应 N2O4(g)![]() 2NO2(g) △H > 0 ,在温度分别为T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是__________。
2NO2(g) △H > 0 ,在温度分别为T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是__________。
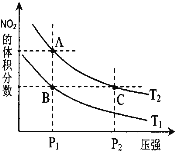
a.A、C 两点的反应速率:A>C
b.A、C 两点的化学平衡常数:A>C
c.A、C 两点 N2O4的转化率:A>C
d.由状态 B 到状态 A,可以用加热的方法
【答案】NO(g)+CO2(g) = NO2(g)+CO(g) ΔH=+234 kJ·mol1 < > c 20% c d
【解析】
⑴根据下面能量变化示意图,焓变等于反应物活化能减去生成物活化能。
⑵①该反应是吸热反应,升高温度,平衡向吸热反应即正向移动,平衡常数增大;②该反应是气体体积增加的反应,混乱程度增加;③根据判断平衡的标志的方法进行分析;④建立三段式,再根据平衡时混合气体的物质的量进行计算。
⑶根据平衡移动方法分析。
⑴根据下面能量变化示意图, NO和CO2反应的热化学方程式NO(g)+CO2(g) = NO2(g)+CO(g) ΔH=368 kJ·mol1-134 kJ·mol1=+234 kJ·mol1;故答案为:NO(g)+CO2(g) = NO2(g)+CO(g) ΔH=+234 kJ·mol1。
⑵①该反应是吸热反应,升高温度,平衡向吸热反应即正向移动,平衡常数增大,因此K1<K2;故答案为:<。
②该反应是气体体积增加的反应,混乱程度增加,因此反应的熵变S>0;故答案为:>。
③a.容器内N2、H2、NH3的物质的量之比为1∶3∶2,不能作为判断平衡标志;b.υ(NH3)正、υ(H2)逆,满足两个不同方向,但速率比不等于计量系数之比,因此不能作为判断平衡标志;c.混合气体平均相对分子质量等于气体质量除以气体物质的量,气体质量不变,气体物质的量增大,混合气体平均相对分子质量减小,当容器内混合气体平均相对分子质量保持不变,则达到平衡;d.混合气体的密度等于气体质量除以容器体积,气体质量不变,容器体积不变,密度始终不变,因此混合气体的密度保持不变,不能作为判断平衡的标志;故答案为:c。
④一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。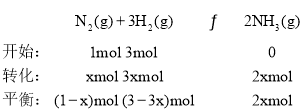 ,
,![]() ,解得x=0.2,则N2的转化率
,解得x=0.2,则N2的转化率![]() ;故答案为:20%。
;故答案为:20%。
⑶a.A、C 两点温度相同,C点压强大,因此A、C 两点的反应速率:C>A;b.A、C 两点温度相同,因此A、C 两点的化学平衡常数相同;c.从A点到C点,加压,平衡逆向移动,N2O4的转化率减小,因此A、C两点N2O4的转化率:A>C;d.B、C两点压强相同,从B到A,NO2体积分数增大,平衡正向移动,即升温,因此由状态B到状态A,可以用加热的方法得到;故答案为:cd。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】有X、Y、Z、Q、T五种元素,X原子的M层p轨道有2个未成对电子,Y原子的外围电子构型为3d64s2,Z原子的L电子层的p能级上有一空轨道,Q原子的L电子层的p能级上只有1对成对电子,T原子的M电子层上p轨道半充满。试写出:
(1)X的元素符号____,Y的元素符号___。
(2)Z的电子排布式___,Q的电子排布式___。
(3)Y的单质在Q的单质中燃烧的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中或实验室中的常用物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)实验用品:电极(__、__)、稀硫酸、__、__耳机(或电流计).
(3)①按如图所示装置连接好实验仪器,这时可以听见耳机发出“嚓嚓……”的声音。其原因是在原电池中化学能转化为__,在耳机中__又转化为声波这种能量。
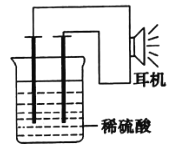
②在该原电池内中,Fe在___极发生了___反应,H+在___极发生了___反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中数据判断,下列选项结论正确的是( )
酸 | H2C2O4 | HCN | H2CO3 |
电离常数(25℃) | K1=5.4×10-2 K2=5.4×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
A.NaCN+H2O+CO2(少量) = HCN+NaHCO3
B.0.1 molL-1的Na2CO3溶液逐渐滴加到同浓度的 HCN 溶液中,无现象,说明未发生反应
C.浓度均为 0.1 molL-1的Na2CO3、NaHCO3、NaCN、NaHC2O4溶液,pH 最大的是NaCN
D.NaHC2O4溶液中,离子浓度由大到小的顺序是c(Na+)>c(H+)>c(HC2O![]() ) >c(C2O
) >c(C2O![]() ) >c(OH-)
) >c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() →
→![]() 。应用这一反应,下列化合物中可以与钠合成环丁烷的是( )
。应用这一反应,下列化合物中可以与钠合成环丁烷的是( )
A.CH3BrB.CH3CH2CH2CH2Br
C.CH2BrCH2CH2CH2BrD.CH3CHBrCH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol·L-1NaOH溶液滴定新配制的25.0mL0.02 mol·L-1FeSO4溶液,应用手持技术测定溶液的pH与时间(t)的关系,结果如右图所示。下列说法错误的是
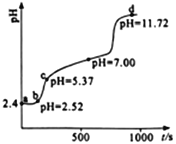
A. ab段,溶液中发生的主要反应:H++OH-=H2O
B. bc段,溶液中c(Fe2+) > (Fe3+) >c(H+)>c(OH-)
C. d点,溶液中的离子主要有Na+、SO42-、OH-
D. 滴定过程发生了复分解反应和氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
⑴基态砷原子中能量最高的能级为________,下列有关表示基态氮原子的排布图中,仅违背洪特规则的是________。
A.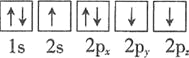
B.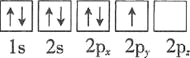
C.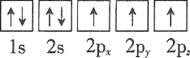
D.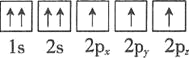
⑵肼是一种良好的火箭发射燃料,传统制备肼的方法是NaClO + 2NH3 = N2H4 + NaCl + H2O,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
①氮、氧、钠三种元素的第一电离能由大到小的顺序为________。
②N2H4中氮原子的杂化轨道类型为________,H2O的分子构型为________。
③NH3、H2O两分子中心原子杂化类型相同,但水分子中键角比NH3中的键角小,其原因是________________________________________,导致肼与氨气熔点、沸点差异最主要的原因是______________________________________________________________。
⑶有“半导体贵族”之称砷化镓晶体中,As、Ga原子最外电子层均达到8电子稳定结构,则该晶体中的化学键的类型有________。
A. 离子键 B. 极性键 C. 配位键 D. ![]() 键
键
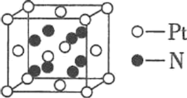
⑷由氮、铂(Pt)两元素形成的某种二元化合物的晶胞如图所示,则该化合物的化学式________,若该晶胞的边长为d pm,则该晶体的密度为________ gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂。
(1)Fe基态原子核外电子排布式为________________________。
(2)H、N、O的电负性从小到大的顺序是_________________。
(3)与NO![]() 互为等电子体的一种分子为__________(填化学式)。氨基(-NH2)中氮原子的杂化类型为_____________。
互为等电子体的一种分子为__________(填化学式)。氨基(-NH2)中氮原子的杂化类型为_____________。
(4)1mol苯胺分子中含有σ键的数目为_____________________。
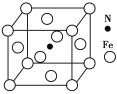
(5)Fe与N形成的某化合物晶胞如图所示,则该晶体的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置______________________________________________
(2)F元素的最高价氧化物对应的水化物的化学式为___________________________________。
(3)元素C、D、E形成的简单离子半径由小到大的顺序________________________(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:__________________________________________________。
C、D还可形成化合物D2C2,D2C2中含有的化学键是_________________________________________。
(5)C、E的氢化物,沸点由高到低顺序是:_______________________________。
(6)写出碳单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式,并用单线桥标明电子的转移方向_______________。当转移电子为0.2mol时,标准状况下反应产生气体_______________L。
(7)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com