
【题目】根据表中数据判断,下列选项结论正确的是( )
酸 | H2C2O4 | HCN | H2CO3 |
电离常数(25℃) | K1=5.4×10-2 K2=5.4×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
A.NaCN+H2O+CO2(少量) = HCN+NaHCO3
B.0.1 molL-1的Na2CO3溶液逐渐滴加到同浓度的 HCN 溶液中,无现象,说明未发生反应
C.浓度均为 0.1 molL-1的Na2CO3、NaHCO3、NaCN、NaHC2O4溶液,pH 最大的是NaCN
D.NaHC2O4溶液中,离子浓度由大到小的顺序是c(Na+)>c(H+)>c(HC2O![]() ) >c(C2O
) >c(C2O![]() ) >c(OH-)
) >c(OH-)
【答案】A
【解析】
根据电离常数得出酸强弱顺序为H2C2O4>![]() >H2CO3>HCN>
>H2CO3>HCN>![]() 。
。
A. 利用强酸制弱酸原理得到NaCN+H2O+CO2(少量) = HCN+NaHCO3,故A正确;
B. 0.1 molL1的Na2CO3溶液逐渐滴加到同浓度的HCN溶液中,无现象,但反应生成了NaCN和NaHCO3,故B错误;
C. 根据对应的酸越弱,水解程度越大,因此浓度均为0.1 molL1的Na2CO3、NaHCO3、NaCN、NaHC2O4溶液,pH最大的是Na2CO3,故C错误;
D. NaHC2O4溶液中,![]() 的水解平衡常数
的水解平衡常数![]() ,Ka2>Kh,则草酸氢根电离程度大于水解程度,因此离子浓度由大到小的顺序是c(Na+)> c(
,Ka2>Kh,则草酸氢根电离程度大于水解程度,因此离子浓度由大到小的顺序是c(Na+)> c(![]() )>c(H+)>c(
)>c(H+)>c(![]() ) > c(OH-),故D错误。
) > c(OH-),故D错误。
综上所述,答案为A。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池总反应可表示为:![]() ,“水”电池在放电时:
,“水”电池在放电时:
(1)该电池的负极的电极反应式为__________________________
(2)![]() 不断向“水”电池的_________极移动
不断向“水”电池的_________极移动
(3)每有![]() 电子转移,生成_________
电子转移,生成_________![]()
(4)将该“水”电池与如图所示的装置相连

![]() 、Y为石墨,a为2L一定物质的量浓度的KCl溶液,电解一段时间发现Y极附近产生了黄绿色气体,写出电解总反应的化学方程式_____________.
、Y为石墨,a为2L一定物质的量浓度的KCl溶液,电解一段时间发现Y极附近产生了黄绿色气体,写出电解总反应的化学方程式_____________.
![]() 、Y分别为铁、铜,a为
、Y分别为铁、铜,a为![]() 和
和![]() 的混合溶液,电池与X、Y的连接方式与
的混合溶液,电池与X、Y的连接方式与![]() 相同,Y极的电极反应式为 ____________.
相同,Y极的电极反应式为 ____________.
(5)室温时,取上述![]() 中
中![]() 电解一段时间后的溶液,除去其中的
电解一段时间后的溶液,除去其中的![]() 且不引入新的杂质
且不引入新的杂质![]() 得到溶液甲,将甲溶液逐滴加入到20ml等物质的量浓度的醋酸中,得到如图
得到溶液甲,将甲溶液逐滴加入到20ml等物质的量浓度的醋酸中,得到如图![]() 不考虑能量损失和气体溶于水,溶液体积变化忽略不计
不考虑能量损失和气体溶于水,溶液体积变化忽略不计![]()

![]() 醋酸的电离平衡常数:C点________B点
醋酸的电离平衡常数:C点________B点![]() 填“
填“![]() ”,“
”,“![]() ”或“
”或“![]() ”
” ![]()
![]() 点溶液中的溶质是:_____________
点溶液中的溶质是:_____________![]() 填化学式
填化学式![]()
![]() 图中,从A点到D点的下列有关说法正确的是______________
图中,从A点到D点的下列有关说法正确的是______________![]() 填字母
填字母![]()
![]() 点时测得溶液中水电离的
点时测得溶液中水电离的![]() 浓度为
浓度为![]() ,则原醋酸溶液的浓度为
,则原醋酸溶液的浓度为![]()
![]() 点时,
点时,![]()
![]() 点时,已知
点时,已知![]() 的
的![]() 大于
大于![]() 的
的![]() ,则溶液中离子浓度的大小关系为:
,则溶液中离子浓度的大小关系为:![]()
![]() 点的溶液
点的溶液![]() 冷却至室温
冷却至室温![]() 等于7
等于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )

A.装置中存在“化学能→电能→光能”的转化
B.锌片上发生的电极反应为![]()
C.如果将稀硫酸换成柠檬汁,则导线中不会有电子流动
D.如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol·L-1NaOH溶液滴定新配制的25.0mL0.02 mol·L-1FeSO4溶液,应用手持技术测定溶液的pH与时间(t)的关系,结果如右图所示。下列说法错误的是
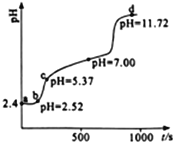
A. ab段,溶液中发生的主要反应:H++OH-=H2O
B. bc段,溶液中c(Fe2+) > (Fe3+) >c(H+)>c(OH-)
C. d点,溶液中的离子主要有Na+、SO42-、OH-
D. 滴定过程发生了复分解反应和氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是__________(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再通入CO___________。
(5)该反应的逆反应速率随时间变化的关系如下图:

①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)___________。(单选)
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线______________
查看答案和解析>>
科目:高中化学 来源: 题型:
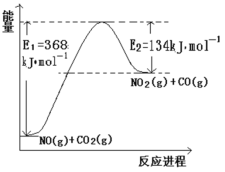
【题目】氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
⑴根据下面能量变化示意图,请写出 NO 和 CO2反应的热化学方程式_________。
⑵在固定体积的密闭容器中,进行如下化学反应:2NH3(g)![]() N2(g)+3H2(g) △H>0,其平衡常数 K 与温度 T 的关系如下表:
N2(g)+3H2(g) △H>0,其平衡常数 K 与温度 T 的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K | 4.1×106 | K1 | K2 |
①试判断 K1_________K2(填写“>”,“<”或“=”);
②该反应的熵变S_________0(填 >、< 或 = )
③下列各项能说明该反应已达到平衡状态的是_________(填字母);
a.容器内N2、H2、NH3的物质的量之比为1∶3∶2 b.2υ(NH3)正 = 3υ(H2)逆
c.容器内混合气体平均相对分子质量保持不变 d.混合气体的密度保持不变
④一定温度下,在 1L 密闭容器中充入 1molN2和 3molH2 并发生反应。若容器容积恒定,10min 达到平衡时,气体的总物质的量为原来的9/10,则N2的转化率![]() (N2)=_________________
(N2)=_________________
⑶对反应 N2O4(g)![]() 2NO2(g) △H > 0 ,在温度分别为T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是__________。
2NO2(g) △H > 0 ,在温度分别为T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是__________。
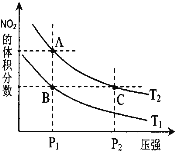
a.A、C 两点的反应速率:A>C
b.A、C 两点的化学平衡常数:A>C
c.A、C 两点 N2O4的转化率:A>C
d.由状态 B 到状态 A,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的HA和HB分别与0.10mol/L的NaOH溶液等体积混合,实验记录如下表:
实验编号 | 加入的酸 | 加入酸的浓度/(mol/L) | 混合后溶液的pH |
① | HA | 0.10 | 8.7 |
② | HB | 0.12 | 2 |
下列说法中正确的是
A. HA是强酸,HB是弱酸
B. 升高温度,溶液②中c(B-)/c(Na+)增大
C. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH->c(H+)
D. 溶液②中离子浓度的关系:c(Na+)+c(H++c(B-)=0.12 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10mol·L的氨水滴定l0.00mL0.05mol·L-1H2A溶液,加入氨水的体积(V)与溶液中lg![]() 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
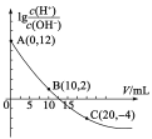
A.A点溶液的pH等于1
B.由图中数据可知,H2A为弱酸
C.B点水电离出的H+离子浓度为1.0×10-6mol·L-1
D.C点溶液中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com