
(1)①48 g RO42-中,核外电子总数比质子总数多6.02×1023个,则R原子的摩尔质量为 。
②有一真空瓶的质量为M1 g,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为 。
(2)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为 ;
②所得溶液中Cl-的物质的量为 mol。
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:单选题
NA代表阿伏加德罗常数,下列说法正确的是( )
| A.在同温同压下,相同体积的任何气体单质所含的原子数相等 |
| B.2g氢气所含原子数为NA |
| C.在常温常压下,11.2LN2所含原子数为NA |
| D.17gNH3所含电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示;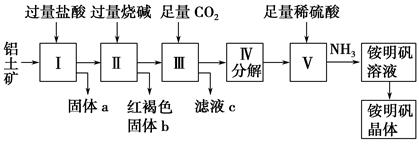
请回答下列问题:
(1)固体a的化学式为 ,Ⅲ中通入足量CO2气体发生反应的离子方程式为 。
(2)由Ⅴ制取铵明矾溶液的化学方程式为 ,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称) 、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1 L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如图
所示。请回答下列问题:
(1)b点时M的组成成分为______________________。
(2)若要使b点生成的盐的质量变为8.4 g,则应继续向溶液中通入二氧化碳________L(标准状况下)。
(3)若向生成的7.16 g盐的溶液中加入一定量的某物质,充分反应后,减压低温蒸发得到纯净的碳酸钠固体(无结晶水)8.4 g。
①若只加入0.03 mol某物质,则加入的物质可以是________或________;
②若只加入0.06 mol某物质,则加入的物质可以是________、________或________。
(4)常温下,同浓度的碳酸钠溶液和碳酸氢钠溶液的pH
都大于7,二者中________的pH更大,理由是________________________;0.1 mol·L-1碳酸钠溶液中离子浓度的大小关系是________;向碳酸氢钠溶液中逐滴滴入氢氧化钡溶液,发生反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫、氮、碳、铁、铜等常见元素在化合物中常表现出多种价态,如硫有-2、-1、+2、+4、+6等价态。这些元素在化工生产中有着重要应用。
(1)31.2g镁与碳粉的混合物在一定条件下恰好完全反应,再加入足量水,得到40.6g白色沉淀,同时产生密度为1.4107g/L(标准状况)的丙二烯和不饱和烃X的混合气体。
①镁与碳粉的反应产物的化学式为 ______________ 。
②原混合物中碳粉的物质的量分数为 ___________。(用小数表示,保留2位小数)
(2)某复杂盐由三种元素组成,含两种阳离子和两种阴离子。取21.76g该复杂盐,平均分为两份。将第一份溶于足量盐酸酸化的氯化钡溶液,所得沉淀中含9.32g硫酸钡。将第二份溶于足量热浓硝酸,再滴加足量硝酸钡溶液,得13.98g白色沉淀,过滤后向蓝色滤液中加足量烧碱溶液,过滤、洗涤、灼烧,得8.00g黑色固体。
①该复杂盐的化学式为_____________。
②该复杂盐中两种阳离子的质量比为 _________________ 。
(3)某地质学家经勘测发现一种新的磁黄铁矿,主要成分为Fe1-xS1+x,杂质不含Fe、S。分析可知该磁黄铁矿中,铁元素中三价铁的质量分数为75%。取5吨 73%的该磁黄铁矿,用接触法制硫酸,若沸腾炉中煅烧的损耗率为4%,接触室中反应的转化率为94%,SO3的吸收效率为97%,则最多可制得98.3%的浓硫酸的质量是________________。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
近几年地球发生地震灾害较多,抢救地震后被困在废墟下的伤员,首要的措施是给伤员补充能量。下图是医院给伤员输液时用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列的内容后填写:
(1)葡萄糖的摩尔质量为________;
(2)该溶液中含水________g;
(3)该溶液的密度约为________g/mL;
(4)该溶液的物质的量浓度为________mol/L(精确到小数点后面两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________ mol·L-1。
(2)该同学取100 mL该“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)=________ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是________。
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是________。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。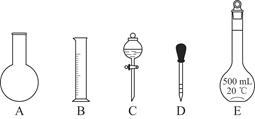
②下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为________g。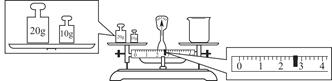
④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com