
 B(g)+C(g)。若反应物的浓度由3 mol·L-1降到1.8 mol·L-1需30 s,那么反应物浓度由0.8 mol·L-1降至0.2 mol·L-1所需反应时间为( )
B(g)+C(g)。若反应物的浓度由3 mol·L-1降到1.8 mol·L-1需30 s,那么反应物浓度由0.8 mol·L-1降至0.2 mol·L-1所需反应时间为( )| A.15 s | B.大于15 s | C.小于15 s | D.无法判断 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:计算题
 3C。反应经2 min后,A的浓度从开始时的1.0 mol/L 降到0.8 mol/L。
3C。反应经2 min后,A的浓度从开始时的1.0 mol/L 降到0.8 mol/L。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3已达平衡,如果保持其他条件不变,只增加N2的浓度,则 ( )
2NH3已达平衡,如果保持其他条件不变,只增加N2的浓度,则 ( )| A.只有正反应速率增大 | B.逆反应速率减小 |
| C.正逆反应速率同时增大 | D.正逆反应速率同时减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.活化分子之间的碰撞一定是有效碰撞 |
| B.增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快 |
| C.对于有气体参加的反应缩小体积,可使单位体积内活化分子增多,反应速率加快 |
| D.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。 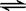 Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g) 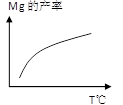
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)+D(g),在不同条件下的反应速率如下,其中反应速率最快的是( )
2C(g)+D(g),在不同条件下的反应速率如下,其中反应速率最快的是( )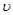 (A)="0.5" mol/(L·S) B.
(A)="0.5" mol/(L·S) B.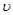 (B)=" 0.6mol/(L·S)"
(B)=" 0.6mol/(L·S)" 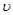 (C)="0.8" mol/(L·S) D.
(C)="0.8" mol/(L·S) D.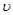 (D)= 0.9mol/(L·S)
(D)= 0.9mol/(L·S)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com