
����Ŀ�������£���һ���������ڲ���һ����©���ҿ��Ի����Ļ������������ָ���������ҡ����ҳ���N2�����ҳ���H2��O2����������ʹN2ռ���������1��4����ͼ����Ȼ���ȼH2��O2�Ļ�����壬��Ӧ��Ϻ�ָ���ԭ�����¶ȣ���������ͣ�����������м䡣�����飬��ʱ�����������ʹ�����ǵ�ľ����ȼ��
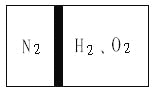
��1����ӦǰH2��O2�����ʵ���֮�ȡ�
��2����ӦǰH2��O2��������ƽ����Է���������
���𰸡�(1)4:5 (2)18.7
��������
��1������ѹǿ�ȵ������ʵ����ȷ������������������ʵ�����
��2��������Է�����������ֵ�ϵ���Ħ��������Ħ�������������������ʵ�����ֵ������
��1���赪�������ʵ���Ϊ1mol�����ҳ��뵪��������Ϊ�����������Ļ�����壬����������������ķ�֮һ������ѹǿ��ȣ���������ʵ�����ֵ�������֮�ȣ������������������ʵ����ܹ�Ϊ3mol�����ݷ�Ӧ��������м䲿�֣�˵��������������Ӧ��ʣ��1mol���壬��Ӧ�������������ܹ�Ϊ2mol�����ݷ�Ӧ����ʽ���������������ʵ���Ϊ4/3mol������ʣ��������ʹ�����ǵ�ľ����ȼ˵��Ϊ��������ԭ���������������ʵ���Ϊ3-4/3=5/3mol�������������������ʵ�����Ϊ4/3:5/3=4:5���ʴ�Ϊ��4:5��
��2����Ӧǰ�����������Ļ���������Է�������Ϊ![]() = 18.7���ʴ�Ϊ��18.7��
= 18.7���ʴ�Ϊ��18.7��


 ����ѧ����ϵ�д�
����ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���о���Ӧ![]() �������仯�����ijͬѧ�������ͼ��ʾʵ��װ�á�����ʢ�й���A��A����ˮ��Ӧ�����Թ��еμ���ҺBʱ������U�ι��м״�Һ���½����Ҵ�Һ���������Իش��������⡣
�������仯�����ijͬѧ�������ͼ��ʾʵ��װ�á�����ʢ�й���A��A����ˮ��Ӧ�����Թ��еμ���ҺBʱ������U�ι��м״�Һ���½����Ҵ�Һ���������Իش��������⡣
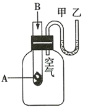
(1)�������ķ�Ӧ________�������ų���������������������
(2)�μӷ�Ӧ��A��B��������________���������������������������ɵ�C��D����������
(3)�÷�Ӧ�����ʵĻ�ѧ��ͨ����ѧ��Ӧת����________�ͷų�����
(4)�÷�Ӧ�У����ѷ�Ӧ���л�ѧ�����յ�����________�������������������������γ��������л�ѧ���ų���������
(5)д��һ���������������Ļ�ѧ����ʽ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̡���ѧ���ļ������γ�(���)1mol��ѧ��ʱ�ͷ�(������)����������֪����P4O6�ķ��ӽṹ��ͼ��ʾ�����ṩ���»�ѧ���ļ���(kJ/mol)��P-P��198��P-O��360��O=O��498�����ڷ�ӦP4(����)+3O2=P4O6�У�����1mol���������仯Ϊ�� ��
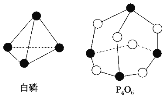
A.����1638kJB.�ų�1638kJC.����126kJD.�ų�126kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Q��X��Y��ZΪ������Ԫ�أ����������ڱ��е�λ����ͼ��ʾ����4��Ԫ�ص�ԭ������������֮��Ϊ22������˵����ȷ����
![]()
A. Y��ԭ�Ӱ뾶��X�Ĵ�
B. Q������������ˮ��������Ա�Z��ǿ
C. X��Y����3��Ԫ���γɵĻ������ж�ֻ�й��ۼ�
D. Q�ĵ��ʾ��а뵼������ʣ�Q��Z���γɻ�����QZ4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(NH3��BH3)��ؿ��ڳ����¹�����װ����ͼ��ʾ���õ�ع���ʱ���ܷ�ӦΪ��NH3��BH3+3H2O2=NH4BO2+4H2O������˵��������ǣ� ��

A. װ�����缫Ϊ�����������ɸü�����������ͨ���������������Һ���ص�����
B. �����ķ�ӦʽΪ��H2O2+2H++2e��=2H2O
C. ��ع���ʱ��H+ͨ�����ӽ���Ĥ�������ƶ���
D. ����3.lg�����飬������ת��0.6mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ִ�����Ⱦ״̬��������Դͷ���ֶ�������������β������ҵ�ŷš������ﳾ���������գ�������ɽ�緢�ȡ�
��1������β���е�NO��g����CO��g����һ���¶Ⱥʹ����������¿ɾ�����
����֪���ֻ�ѧ���ļ�������
����ʽ/�ṹʽ | NO/N��O | CO/C��O | CO2/O=C=O | N2/N��N |
��ѧ�� | N��O | C��O | C=O | N��N |
����( kJ/mol) | 632 | 1072 | 750 | 946 |
���������β��������NO��g����CO��g��������Ӧ���Ȼ�ѧ����ʽ
2NO��g��+2CO�� g�� ![]() N2�� g��+2CO2��g�� ��H=_____kJ��mol-1
N2�� g��+2CO2��g�� ��H=_____kJ��mol-1
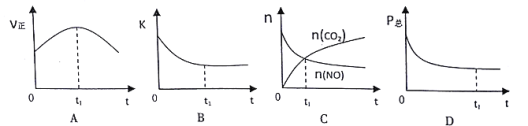
����������Ӧ�ں��¡����ݵ��ܱ���ϵ�н��У�����t1ʱ�̴ﵽƽ��״̬��������ʾ��ͼ����������� ____����ѡ����ţ�������ͼ��V����K��n��P���ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ�������ѹǿ��
��2����t1���£������Ϊ10 L�ĺ����ܱ�������ͨ��NO��CO����ò�ͬʱ��NO��CO�����ʵ������±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/��10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/��10-1 mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1��ʱ�÷�Ӧ��ƽ�ⳣ��K= ___����������Ӧ��������ʹƽ�������ƶ��Ĵ�ʩ��_____����д��һ�ּ��ɣ�
��3��NH3����ԭ�������SCR��������ĿǰӦ����㷺���������������ѳ��������ڰ�������������£���ͬc��NO2��/C��NO������ͬ�¶ȶ��ѵ��ʵ�Ӱ����ͼ��ʾ����֪��������ԭ�������������ӦΪ���ȷ�Ӧ������ش��¶ȶ��ѵ��ʵ�Ӱ��________�����������Ľ��ͣ�____________��
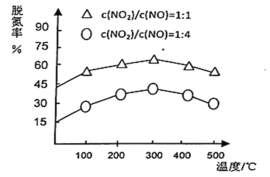
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��Ӿ����ڼ��Է���������ԭ�Ӿ�Ϊsp3�ӻ�����
A. SO2��BF3B. PCl3��SO3C. CH4��SiO2D. NF3��H2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�ҷ�����һ�ְ�ȫ�ɳ�������ˮϵ�����ӵ�أ�����������ˮ��ϸ��������Ϊ����ʣ���طŵ���ܷ�ӦʽΪ��Na0.44MnO2+NaTi2(PO4)3=Na0.44��xMnO2+Na1+xTi2(PO4)3���乤��ԭ������ͼ��
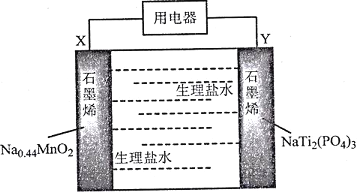
����˵���������
A. �ŵ�ʱ��Cl����X���ƶ�
B. �õ�س��ʱY��Ӧ�����Դ����������
C. ���ʱ��������ӦΪ��NaTi2(PO4)3+xNa++xe-=Na1+ xTi2( PO4)3
D. �õ�ؿ�����Ϊ��ֲ������ĵ���ҽ���豸�ĵ�Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���������ɶ����ڲ���Ԫ����ɵĵ��ʻ��仯���ͼ�в��ַ�Ӧ����������δ�г�����֪��A��C��D��F��Ϊ���ʣ�C��E��F��G�����������壬JΪ��ɫ��������������B����������E������B��G����ʹʪ��ĺ�ɫʯ����ֽ��������B����ɫ��Ӧ��Ӧ�ʻ�ɫ����Ӧ![]() �ǻ��ʹ�ҵ����Ҫ��Ӧ��
�ǻ��ʹ�ҵ����Ҫ��Ӧ��
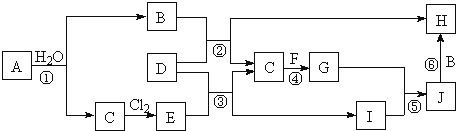
��ش��������⣺
(1)![]() ��Ԫ����Ԫ�����ڱ��е�λ����______������B�ĵ���ʽΪ______��
��Ԫ����Ԫ�����ڱ��е�λ����______������B�ĵ���ʽΪ______��
(2)������Ӧ![]() �У����ڻ��Ϸ�Ӧ����______����Ӧ
�У����ڻ��Ϸ�Ӧ����______����Ӧ![]() �����ӷ���ʽΪ______��
�����ӷ���ʽΪ______��
(3)��I��ˮ��Һ�μ�B��Һ�������Ĺ����У����۲쵽������Ϊ______��
(4)��֪G����![]() �����û���Ӧ�����Ը÷�ӦΪԭ������ʯī���缫����ԭ��أ������ĵ缫��Ӧʽ��______��
�����û���Ӧ�����Ը÷�ӦΪԭ������ʯī���缫����ԭ��أ������ĵ缫��Ӧʽ��______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com