
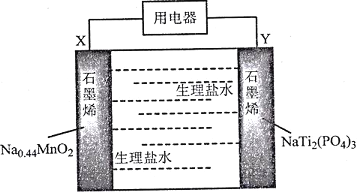
【题目】我国科学家发明了一种安全可充电的柔性水系钠离子电池,可用生理盐水或细胞培养基为电解质,电池放电的总反应式为:Na0.44MnO2+NaTi2(PO4)3=Na0.44-xMnO2+Na1+xTi2(PO4)3,其工作原理如下图。
下列说法错误的是
A. 放电时,Cl-向X极移动
B. 该电池充电时Y极应该与电源的正极相连
C. 充电时,阴极反应为:NaTi2(PO4)3+xNa++xe-=Na1+ xTi2( PO4)3
D. 该电池可能作为可植入人体的电子医疗设备的电源
【答案】C
【解析】
A.根据放电反应方程式可知:在反应中Na0.44MnO2失去电子变为Na0.44-xMnO2,Mn元素化合价升高,因此X电极为负极,电池工作时,溶液中的阴离子Cl-向负极X区移动,A正确;
B.根据反应方程式可知放电时,X电极为负极,负极发生氧化反应,Y电极为正极,正极上发生还原反应,则该电池充电时Y极应该与电源的正极相连,作阳极,发生氧化反应,B正确;
C.充电时,X电极与电源的负极连接,作阴极,阴极反应为:Na0.44-xMnO2+xe-+xNa+= Na0.44MnO2,C错误;
D.该电池是一种安全可充电的柔性水系电池,因此可能作为可植入人体的电子医疗设备的电源,D正确;
故合理选项是C。


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
【题目】如图为乙酸丁酯制备的实验装置,下列说法正确的是
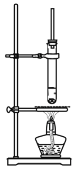
A.玻璃导管的主要作用是平衡试管内外压强
B.该装置适用于乙酸乙酯的制备
C.加入过量乙酸可以提高丁醇的转化率
D.分离提纯乙酸丁酯的方法是将混合物直接分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在一刚性容器内部有一个不漏气且可以滑动的活塞,将容器分割成左右两室。左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的1/4(如图)。然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞正好停留在容器的中间。经检验,此时右室中气体可使带火星的木条复燃。
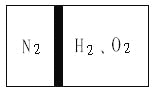
(1)求反应前H2和O2的物质的量之比。
(2)求反应前H2和O2混合气体的平均相对分子质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为C9H10O2,试回答下列有关问题:
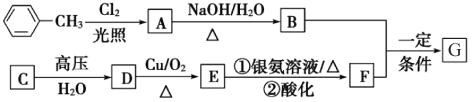
⑴指出下列反应的反应类型:C转化为D:_________。
⑵写出A中官能团的名称:_________。
⑶写出下列反应的化学方程式:
D生成E的化学方程式:_________;E与银氨溶液反应的化学方程式_________;B和F生成G的化学方程式:_________。
⑷写出符合下列条件的G的同分异构体的结构简式:_________。
①能与FeCl3发生显色反应
②能与新制的银氨溶液反应产生光亮的银镜
③核磁共振氢谱显示有四种不同化学环境氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧很多实用特性,其强氧化性常用于消毒杀菌和防腐保鲜。目前制取臭氧的方法很多,其中高压放电法(DBD)和电解纯水法原理如图所示。下列说法中错误的是
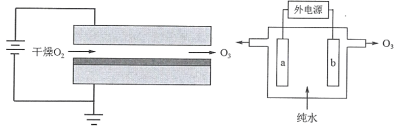
A.两种方法都是将电能转化为化学能
B.高压放电法和电解纯水法相比,会产生污染性的NOx气体
C.电解纯水时,阳极发生的电极反应有3H2O-6e-=O3↑+6H+
D.电解纯水时,H+由电极b流向电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能表示H2(g)+ I2(g)![]() 2HI(g)已经达到平衡状态的标志有几个( )
2HI(g)已经达到平衡状态的标志有几个( )
①c(H2)=c(I2)=c(HI)时②c(H2):c(I2):c(HI)=1:1:2时③c(H2)、c(I2)、c(HI)不再随时间而改变④单位时间内生成nmolH2的同时生成2nmolHI⑤单位时间内生成n mol H2的同时生成n mol I2⑥反应速v(H2)=v(I2)=1/2v(HI)⑦一个H-H键断裂的同时有两个H-I键断裂⑧温度和体积一定时,容器内压强不再变化⑨温度和体积一定时,混合气体的颜色不再变化⑩温度和压强一定时,混合气体的密度不再变化条件一定,混合气体的平均相对分子质量不再变化
A. 3B. 4C. 5D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、1.01×105 Pa下,1mol氢气在氧气中燃烧生成气态水的能量变化如下图所示,下列有关说法正确的是( )
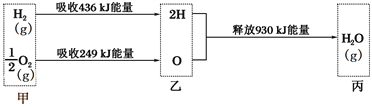
A. H2O分解为H2与O2时放出热量
B. 热化学方程式为:2H2(g) + O2(g) = 2H2O(g) ΔH = -490 kJ·mol-1
C. 甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D. 乙→丙的过程中若生成液态水,释放的能量将小于930 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学理论较为枯燥,若用化学实验来阐释理论,则会使理论具有趣味性,某班级化学学习小组通过实验室制备CO2的反应探究某些化学理论。下表是实验过程中的数据及相关信息:
序号 | 反应 温度/℃ | c(HCl)/(mol·L-1) | V(HCl)/mL | 10g CaCO3 的形状 | t/min |
① | 20 | 2 | 10 | 块状 | t1 |
② | 20 | 4 | 10 | 块状 | t2 |
③ | 20 | 2 | 10 | 粉状 | t3 |
④ | 40 | 2 | 10 | 粉状 | t4 |
⑤ | 40 | 4 | 10 | 粉状 | t5 |
![]() 表示收集CO2体积为a mL所需的时间。注:气体体积均在相同条件下测得。
表示收集CO2体积为a mL所需的时间。注:气体体积均在相同条件下测得。
(1)由表中的信息可知,实验的目的是探究__________。
(2)表格中的实验①和实验②是探究_____对化学反应速率的影响。分析表格中的信息可知,影响该化学反应速率的因素还有______________________________。
(3)收集a mLCO2所需的时间最少的是实验______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HF | HCN | H2CO3 |
电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
(1)c(H+)相同的三种酸溶液的浓度从大到小为___。
(2)若HCN溶液的起始浓度为0.01mol·L-1,平衡时c(H+)约为__mol·L-1。使此溶液中HCN的电离程度增大且c(H+)也增大的方法是__。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a__(填“大于”“小于”或“等于”,下同)b。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1__n2。
(4)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为__。
(5)设计实验证明氢氟酸比HCl的酸性弱__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com