
【题目】能表示H2(g)+ I2(g)![]() 2HI(g)已经达到平衡状态的标志有几个( )
2HI(g)已经达到平衡状态的标志有几个( )
①c(H2)=c(I2)=c(HI)时②c(H2):c(I2):c(HI)=1:1:2时③c(H2)、c(I2)、c(HI)不再随时间而改变④单位时间内生成nmolH2的同时生成2nmolHI⑤单位时间内生成n mol H2的同时生成n mol I2⑥反应速v(H2)=v(I2)=1/2v(HI)⑦一个H-H键断裂的同时有两个H-I键断裂⑧温度和体积一定时,容器内压强不再变化⑨温度和体积一定时,混合气体的颜色不再变化⑩温度和压强一定时,混合气体的密度不再变化条件一定,混合气体的平均相对分子质量不再变化
A. 3B. 4C. 5D. 6
【答案】B
【解析】
①平衡时c(H2)、c(I2)、c(HI)三者可能相等,也可能不等,与各物质的初始浓度及转化率有关,故错误;
②平衡时浓度c(H2):c(I2):c(HI)可能为1:1:2,也可能不等,与各物质的初始浓度及转化率有关,故错误;
③c(H2)、c(I2)、c(HI)不再随时间而改变,说明正逆反应相等,故正确;
④单位时间内生成nmolH2,等效于消耗2nmolHI,同时生成2nmolHI,故正确;
⑤单位时间内生成nmolH2的同时生成nmolI2,都体现逆反应方向,故错误;
⑥只要反应发生,就符合反应速率v(H2)=v(I2)=![]() v(HI),故错误;
v(HI),故错误;
⑦一个HH键断裂等效于两个HI键形成同时有两个HI键断裂,正逆反应速率相等,故正确;
⑧该体系是一个气体体积不变的体系,气体质量、体积和压强都始终不变,温度和体积一定时,容器内压强一直不再变化,故错误;
⑨温度和体积一定时,混合气体的颜色不再变化,说明碘蒸气的浓度不变,反应达平衡状态,故正确;
⑩该体系是一个气体体积不变的体系,气体质量、体积和压强都始终不变,温度和压强一定时,混合气体的密度一直不再变化,故错误;
该体系是一个气体体积不变的体系,气体质量、体积和压强都始终不变,条件一定,混合气体的平均相对分子质量一直不再变化,故错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
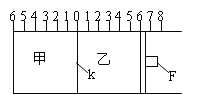
(1)可根据__________现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是____________。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为_____mol,乙中C的转化率________50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度________处(填下列序号:① <6 ② >6 ③ =6)
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为_________;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
化学键 | N≡O | C≡O | C=O | N≡N |
键能( kJ/mol) | 632 | 1072 | 750 | 946 |
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO( g) ![]() N2( g)+2CO2(g) △H=_____kJ·mol-1
N2( g)+2CO2(g) △H=_____kJ·mol-1
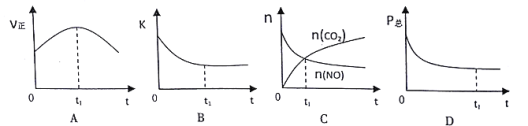
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图符合题意的是 ____(填选项序号)。(下图中V正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
(2)在t1℃下,向体积为10 L的恒容密闭容器中通入NO和CO,测得不同时间NO和CO的物质的量如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/×10-1 mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K= ___,既能增大反应速率又能使平衡正向移动的措施是_____。(写出一种即可)
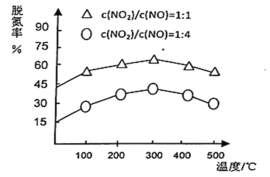
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/C(NO)、不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响________,给出合理的解释:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.保持容器体积不变,增加H2O(g)的量
B.保持容器体积不变,充入氦气使体系压强增大
C.将容器的体积缩小一半
D.保持容器压强不变,充入氦气使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明了一种安全可充电的柔性水系钠离子电池,可用生理盐水或细胞培养基为电解质,电池放电的总反应式为:Na0.44MnO2+NaTi2(PO4)3=Na0.44-xMnO2+Na1+xTi2(PO4)3,其工作原理如下图。
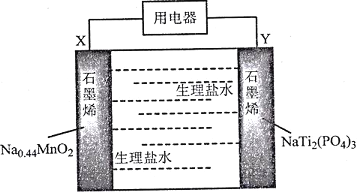
下列说法错误的是
A. 放电时,Cl-向X极移动
B. 该电池充电时Y极应该与电源的正极相连
C. 充电时,阴极反应为:NaTi2(PO4)3+xNa++xe-=Na1+ xTi2( PO4)3
D. 该电池可能作为可植入人体的电子医疗设备的电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是

A.Y、Z、W三种元素电负性:W>Z>Y
B.Y、Z、W三种元素第一电离能:Z>W>Y
C.L的沸点一定比X、Y组成的化合物沸点高
D.由X、Y、Z、W构成的化合物中可能只含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是

A. 好氧微生物反应器中反应为:NH4++2O2==NO3-+2H++H2O
B. B极电势比A极电势低
C. A极的电极反应式CH3COO-+8e-+2H2O==2CO2+7H+
D. 当电路中通过1mol电子时,理论上总共生成2.24LN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是( )
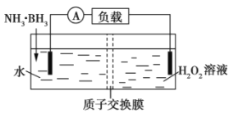
A.正极的电极反应式为2H++2e-═H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作一段时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
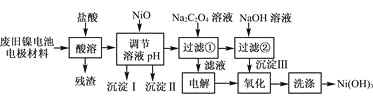
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
|
| 开始沉淀pH | 沉淀完全pH |
|
|
|
|
|
|
|
|
|
|
|
|
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式:_____________________。
(3) 检验电解滤液时阳极产生的气体的方法:___________________________。
(4) 写出“氧化”反应的离子方程式:___________________________________。
(5) 如何检验Ni(OH)3已洗涤干净?_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com