
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)向CuSO4溶液中逐滴滴加氨水至过量,过程中会先有沉淀生成,后沉淀逐渐溶解。
①写出沉淀溶解过程的离子方程式___________________。
②Cu2+基态时核外电子排布式为____________________。
③金属铜采取_____堆积。
④NH3分子空间构型为__________________。
(2)制备CrO2Cl2的反应为:K2Cr2O7+3CCl4=2KC1+2CrO2Cl2+3COC12↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为____________________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相似,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm,则熔点:NiO____FeO(填“>”、“<”或“=”)。
(4)Ni和La的合金是目前使用广泛的储氢材料。具有大容量、高寿命、耐低温等特点,在日本和中国己实现了产业化。该合金的晶胞结构如下图所示。

①该晶体的化学式为_______________________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是_________cm3(用含M、d、NA的代数式表示)。
【答案】 Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O 1s22s22p63s23p63d9或[Ar]3d9 面心立方最密堆积 三角锥形 O>Cl>C 3:1 sp2 > LaNi5 M/NAd
【解析】本题考查物质结构与性质。
解析:(1)①向CuSO4溶液中逐滴滴加氨水时,先生成蓝色的氢氧化铜沉淀,继续滴加氨水,蓝色的氢氧化铜沉淀与氨水反应,生成深蓝色溶液的铜氨络离子,反应的离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;②Cu原子核外电子排布为1s22s22p63s23p63d104s1,4s与3d能级各失去1个电子形成Cu2+,则Cu2+基态核外电子排布式为1s22s22p63s23p63d9;③金属Cu采取面心立方堆积;④NH3分子中N原子的价层电子对数为4,孤对电子对数为1,则空间构型为三角锥形。(2)①反应中有O、C、Cl三种非金属元素参与反应,元素的非金属性越强,电负性越大,非金属性强弱顺序为O>Cl>C,由大到小的顺序是O>Cl>C;②由题意可知,COCl2分子中含有1个C、O双键和2个C、Cl单键,单键都是σ键,双键中1个为σ键和1个π键,则COCl2分子中σ键和π键的个数比为3∶1;因分子中含有C、O双键,所以C原子为sp2杂化。(3)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO。(4)①从图中可以看出,La位于平行六面体的顶点,晶胞中La的原子数为8×![]() =1,平行六面体的上、下两个面各有2个Ni原子,四个侧面各有1个Ni原子,体心还有1个Ni原子,晶胞中Ni的原子数为8×
=1,平行六面体的上、下两个面各有2个Ni原子,四个侧面各有1个Ni原子,体心还有1个Ni原子,晶胞中Ni的原子数为8×![]() +1=5,则该晶体的化学式为LaNi5;②晶胞中含有1个LaNi5,晶胞的质量为
+1=5,则该晶体的化学式为LaNi5;②晶胞中含有1个LaNi5,晶胞的质量为![]() ×M, 根据m=dV,晶胞的体积为
×M, 根据m=dV,晶胞的体积为![]() cm3。点晴:本题难点是晶胞结构的分析与与有关计算。使用均摊法计算晶胞微粒个数时,应意晶胞的形状,不同形状的晶胞应先分析任意位置上的一个微粒被几个晶胞所共有,如六棱柱晶胞中顶点、侧棱点、底面棱点和面心点依次被6、3、4、2不晶胞所共有。
cm3。点晴:本题难点是晶胞结构的分析与与有关计算。使用均摊法计算晶胞微粒个数时,应意晶胞的形状,不同形状的晶胞应先分析任意位置上的一个微粒被几个晶胞所共有,如六棱柱晶胞中顶点、侧棱点、底面棱点和面心点依次被6、3、4、2不晶胞所共有。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】(1)请写出以下物质的电子式:Na2O2__________H2S___________
(2)用“>”或“<”回答下列问题:
酸性:H2SiO3____H3PO4;稳定性:HCl____CH4;氧化性:Cu2+_____Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下
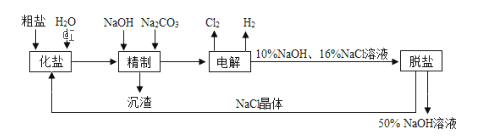
(1)粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的离子方程式是________,________.
(2)如果粗盐中SO42﹣含量较高,必须添加钡式剂除去SO42﹣ ,该钡试剂可以是____
A.Ba(OH)2B.Ba(NO3)2C.BaCl2
(3)电解过程中所发生反应的化学方程式为________,与电源正极相连的电极附近产生的气体是________,检验该气体可使用的试纸及现象是.
(4)氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下:
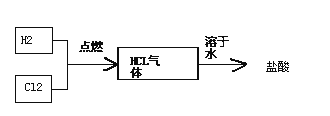
其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是________.合成盐酸厂要求合成气中的HCl的含量要大于97%,试用最简便的方法进行分析是否含量大于97%________.
(5)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为________.
(6)某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显________色,往B试管中通入干燥的氯化氢气体,试纸显________色.最后向C试管中加入物质________(填化学式),他之所以加入这种物质的理由是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. ![]() =1×10-13 mol·L-1的溶液中:NH
=1×10-13 mol·L-1的溶液中:NH![]() 、Ca2+、Cl-、NO
、Ca2+、Cl-、NO![]()
B. 使酚酞变红色的溶液中:Na+、Al3+、SO![]() 、Cl-
、Cl-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO![]() 、SO
、SO![]()
D. 水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、AlO![]() 、CO
、CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是
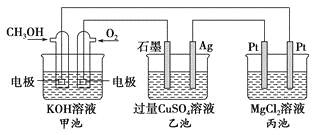
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 乙醇的沸点高于丙烷
B. 氨基酸既能与盐酸反应,也能与NaOH反应
C. 甘油、汽油、植物油不属于同一类有机物
D. 光照时异戊烷发生取代反应生成的一氯代物最多有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硝酸的叙述正确的是( )
A. NO2溶于水生成硝酸,所以NO2是酸性氧化物
B. 硝酸可与活泼金属反应生成盐和氢气
C. 常温下铁与浓硝酸反应,产生大量的红棕色气体
D. 硝酸与铜的反应既表现出氧化性又表现出酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C5H12有3种不同结构:甲[CH3(CH2)3CH3]、乙[CH3CH(CH3)CH2CH3]和丙[C(CH3)4],下列相关叙述正确的是
A. 甲、乙、丙属于同系物,均可与氯气、溴蒸气发生取代反应
B. 甲、乙、内都属于烷烃
C. C6H12表示一种纯净物
D. 乙有3种不同沸点的一氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)被誉为“生命的奇效元素”。富硒食品倍受追捧。已知硒元素与氧元素同族。与钙元素同周期。下列关于硒的描述错误的是
A. 原子序数是24
B. 原子半径比硫原子的原子半径大
C. 最高价氧化物是SeO3,是酸性氧化物
D. 气态氢化物化学式是H2Se,还原性比HCl强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com