
����Ŀ��Na2O2�dz����������ƣ�ij��ѧС���ͬѧ��ͨ������ʵ��ȷ��̿����Na2O2�ķ�Ӧ���
��ʵ�鲽����
��������ͼ��ʾװ������������δ��������װ�����������װ����������

������0.6g̿����3.9gNa2O2���Ȼ�ϣ�װ��Aװ���еķ�Ӧ�������ڿ����Թܿڴ�����һ��ʪ����Ȼ�����ֽ��ʪ���Ȼ�����ֽCO��ڣ������ڼ����Ƿ���CO��������
�����þƾ�������Aװ���еķ�Ӧ����
��ʵ��������
�Թ��з������ҷ�Ӧ���������Ȼ�����ֽδ��ڣ�ʯ��ˮδ�������
�ش�����������
��1����Aװ���з����ڵ���������ѡ��_____________���٢ڢۢܢ���ѡ�������װ�ã�ʹ����װ��ͼ��������

��2��װ��B��������________________��
��3��ͨ��̽�����֣�װ��A��ֻ������Ӧ2Na2O2+C![]() Na2CO3+X����XΪ___________���ѧʽ����
Na2CO3+X����XΪ___________���ѧʽ����
��4��CO�ڳ�ʪ�����пɽ��Ȼ��ٻ�ԭΪ��ɫ��ĩ״������Pd����ͬʱ�����������������ʣ���֪��Ӧ������ת��6.02��1023������ʱ������53g Pd���÷�Ӧ�Ļ�ѧ����ʽΪ________________________��
��5����װ��A����ȫ��Ӧ������������������ˮ�������Һ���ش��������⣺
��������Һ��������___________������ѧʽ����
�����£���ʹ������Һ��100 mLϡ����ǡ����ȫ��Ӧ����ҺpH=7������������ʵ���Ũ��Ϊ___________��
��6��д��Na2O2��һ����Ҫ��;_________________��
���𰸡���1���� ��2����ֹ���� ��3��Na2O
��4��PdCl2+CO+H2O=Pd+CO2+2HC1
��5����NaOH��Na2CO3��1mol/L
��6�����ں����������ΪO2����Դ
��������
�����������1��̼�ۺ������ƶ��ǹ��壬���Ӧѡ��ͼʾװ��
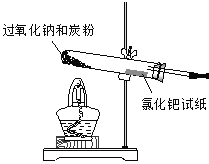
��ѡ������2��CO2���ڳ���ʯ��ˮ���п��ܵ���������װ��B�������Ƿ�ֹ��������3������ԭ���غ��֪��XӦ��������������4��53 g Pd��0.5mol����Ӧ��ת�Ƶ�����1 mol����������������CO2����ʽΪPdCl2 + CO + H2O = Pd + CO2 + 2HCl����5���� ���ò�����̼���ƺ������ƣ���������ˮ�����������������������Һ��������NaOH��Na2CO3���ڹ���������3.9g��78g/mol = 0.05mol��������ԭ���غ��֪���Ȼ�����0.1 mol������Ũ����0.1 mol��0.1 L = 1.0 mol/L����6��2 Na2O2 + 2 CO2 = 2 Na2CO3+O2�������ڿ�ɽ���ӵ���DZˮ������ɴ���ȱ���ij��ϣ������Ǻ�����CO2��ת����O2���Թ�����֮�����������ƾ���ǿ�����ԣ���������Ư��֯����Ʒ����ˡ���ë����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҿ�����һ������ﮡ�����أ��������ܶȼ��ߣ�Ч�ʴ�90%���ϡ���������ӵ⻯���LiI������ˮ������ԭ����ͼ��ʾ���ܷ�ӦΪ��
O2��4LiI��2H2O2I2��4LiOH

���ڸõ�ص�����˵������ȷ������ ��
A���ŵ�ʱ������I�� ������
B�����ʱLi+������������������
C�����ʱ������ӦΪLiOH��e��==Li��OH��
D���ŵ�ʱ������ӦΪO2��2H2O��4Li+��4e��==4LiOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����������װ��̽�������백��֮��ķ�Ӧ������A��F�ֱ�Ϊ�����������ķ���װ�ã�CΪ��������������백����Ӧ��װ�á�

��ش��������⣺
��1��װ��F�з�����Ӧ�����ӷ���ʽΪ____________��
��2��װ��A�е���ƿ�ڹ����ѡ��_________������ĸ��
A.��ʯ�� B.��ʯ�� C.�������� D.����������
��3�����߿���Ӧ���ӱ�Ҫ�ij���װ�ã������ͼ�ı�ѡװ����ѡ��������������пո�
B_________��D__________��E_________��
��4�����������£�NH3����������NO����Ⱦ���������ֶԻ����������ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ��__________________���÷�Ӧ��ÿ���ı�״����8.96LNH3ת�Ƶ���_________mol.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A��78gNa2O2�����������ӵĸ���Ϊ2NA
B����״��1.12L������H2O��Ӧ����Ӧ��ת�Ƶĵ�����Ϊ0.1NA
C��CO2ͨ��Na2O2ʹ������agʱ����Ӧ��ת�Ƶĵ�����ΪaNA/56
D��60gSiO2���еĻ�ѧ����ĿΪ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йذ����ӵ�����NA˵������������ ��
A��22 g 2H218O�к��е�������Ϊ10NA
B�����58.5 g���ڵ�NaCl���ܲ���11.2 L��������״������23.0 g������
C��1.00 mol NaCl�У�����Na+��������������Ϊ10NA
D��1 mol Na������O2��Ӧ������Na2O��Na2O2�Ļ�����ʧȥNA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� VL���� MgSO4�� K2SO4�Ļ����Һ�ֳ����ȷݣ�һ�ݼ��뺬 a mol NaOH ����Һ�� ǡ��ʹMg2+��ȫ����Ϊ Mg(OH��2�� ��һ�ݼ��뺬 b mol BaCl2����Һ�� ǡ��ʹSO42-��ȫ����Ϊ BaSO4����ԭ�����Һ�� K+��Ũ��Ϊ
A. ![]() mol��L1 B.
mol��L1 B. ![]() mol��L1 C.
mol��L1 C. ![]() mol��L1 D.
mol��L1 D. ![]() mol��L1
mol��L1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��Ӧ3A![]() 2B+D�����ֲ�ͬ�����½��У�B��D����ʼŨ��Ϊ0����Ӧ��A��Ũ�� c ��ʱ�� t �ı仯������±���
2B+D�����ֲ�ͬ�����½��У�B��D����ʼŨ��Ϊ0����Ӧ��A��Ũ�� c ��ʱ�� t �ı仯������±���
ʵ�� ��� | t/min C/molL��1 �¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 |
1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
�����������ݣ����������գ�
(1)��ʵ��1�У���Ӧ��10min��20min ��ƽ������Ϊ mol/(Lmin)
(2)��ʵ��2�У�A�ij�ʼŨ�� C2Ϊ mol/L�����Ʋ�ʵ��2�л������������� ��
(3)��ʵ�� 3 �ķ�Ӧ����Ϊv3��ʵ��1�ķ�Ӧ����Ϊv1����v3 v1(�������=)����C3 2.0mol/L (�������=)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��ͬѧ������������̽��Fe3+��ˮ��Һ�е���Ϊ��
���ϣ�i��Fe3+ ��ˮ��Һ����ˮ������������ʽ���ڣ���[Fe(H2O)6]3+��
[Fe(H2O)6]3+��������ˮ�ⷴӦ��
[Fe(H2O)6]3+(������ɫ)+nH2O![]() [Fe(H2O)6-n(OH)n]3-n(��ɫ)+nH3O+(n=0��6)��
[Fe(H2O)6-n(OH)n]3-n(��ɫ)+nH3O+(n=0��6)��
ii.[FeCl4(H2O)2]-Ϊ��ɫ��
��ʵ��I��

��ʵ��II��
�ֱ����Թ��������е��Լ���Ϊ����Һ����ɫ�ȼ�����������������ԽС����Һ��ɫԽ�����Խ������Һ��ɫԽdz��


ͼ1 ͼ2
Fe(NO3)3��Һ�������¶ȱ仯���� FeCl3��Һ�������¶ȱ仯����
��1��ʵ��I�У��Թ�����Һ��Ϊ��ɫ��ԭ���� ��
��2��ʵ��I�У��Թ�����Һ���ػ�ɫ��[FeCl4(H2O)2]-�йأ�֧�ִ˽��۵�ʵ�������� ��
��3����ʵ��IIͼ1��2��֪������ʱ����Һ��ɫ ��������dz�����������������������
��4����ʵ��II�����Եó����½��ۣ�
[����һ]FeCl3��Һ�д���������Ӧ��[FeCl4(H2O)2]-+4H2O![]() [Fe(H2O)6]3++4Cl-
[Fe(H2O)6]3++4Cl-
�ó��˽��۵������� ��
[���۶�] ����һ�з�Ӧ����H ������>0������<0������
��5��ʵ��С��ͬѧ���������һ��ʵ��֤����4���н���һ��ʵ�鷽����ȡ�Թ�������Һ�� ����������Ҫ��ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��RΪ���ֶ�����Ԫ�أ���ԭ�Ӱ뾶������������֮��Ĺ�ϵ����ͼ��ʾ��

����˵������ȷ����
A. �������Ӱ뾶��X< R
B. ��ۺ���������ԣ�Z < Y
C. M���⻯�ﳣ�³�ѹ��Ϊ����
D. X��Y�����γ���������ṹ�ķ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com