
| A. | 锌跟稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率 | |
| B. | 镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 | |
| C. | 钢铁表面常易被锈蚀生成Fe2O3•nH2O | |
| D. | 钢铁在发生析氢腐蚀和吸氧腐蚀时,电极反应相同的是负极反应 |
分析 A、根据原电池能加速负极金属和电解质的反应速率来回答;
B、在原电池中,活泼金属做负极,负极金属更易腐蚀,正极金属被保护;
C、铁锈的主要成分为Fe2O3•nH2O;
D、钢铁在发生析氢腐蚀和吸氧腐蚀时,负极均是金属铁失电子的氧化反应.
解答 解:A、锌跟稀硫酸反应制取氢气,加入少量的硫酸铜,金属铁会和硫酸铜之间反应生成金属铜和硫酸亚铁,金属铁、铜形成的原电池,能加速负极金属铁和电极质硫酸的反应速率,故A正确;
B、白铁(镀锌的铁)中,镀层破损后,Zn为负极,被腐蚀的是Zn,Fe被保护,马口铁(镀锡的铁)中,Fe为负极,被腐蚀的是Fe,Zn被保护,所以镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)铁更耐腐蚀,故B错误;
C、钢铁发生吸氧腐蚀后生成的铁锈的主要成分为Fe2O3•nH2O,故C正确;
D、钢铁在发生析氢腐蚀和吸氧腐蚀时,负极均是金属铁失电子的氧化反应,正极上分别是氧气得电子的还原反应、氢离子得电子的还原反应,故D正确.
故选B.
点评 本题是一道综合知识题目,考查学生对原电池原理的应用知识,可以根据所学知识进行回答,注意原电池原理的应用是解题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
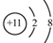 .
.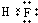 、
、 ,属于两性化合物的电离方程式Al3++3OH-?Al(OH)3 ?H++AlO2-+H2O.
,属于两性化合物的电离方程式Al3++3OH-?Al(OH)3 ?H++AlO2-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2固体中含离子总数为4 NA | |
| B. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 | |
| C. | 常温下,pH=13的NaOH溶液中OH-离子数目为0.1 NA | |
| D. | 3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol,若反应放出9.2 kJ热量,则参加反应的氢分子数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫酸 | B. | 氢硫酸 | C. | 硝酸 | D. | 碘化钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3=2H++CO32- | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | CH3COOH?CH3COO-+H+ | D. | HClO=H++Cl-+O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ④ | C. | ③④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度下,中性溶液的pD≠7.0. | |
| B. | 含0.01mol的NaOD的D2O溶液1L,其pD=12.0. | |
| C. | 溶解0.01mol的DCl的D2O溶液1L,其pD=2.0. | |
| D. | 在100mL0.25mol/L的DCl重水溶液中,加入50mL0.2mol/L的NaOD的重水溶液,其pD=1.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com