
【题目】将0.03molCl2缓缓通入含0.02molH2SO3和0.02molHBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变)( )
A.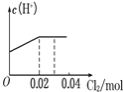 B.
B.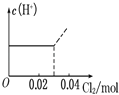
C.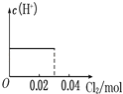 D.
D.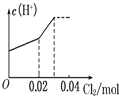
【答案】A
【解析】
当氧化剂相同时,先和还原性强的物质反应,因此氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br-,由于Br-全部转变Br2,所以HBr和H2SO3都完全被氧化。
因为亚硫酸的还原性强于HBr,因此氯气先氧化亚硫酸,后氧化HBr;
Cl2 + H2SO3 + H2O=H2SO4 + 2HCl
0.02mol 0.02mol 0.02mol 0.04mol
H2SO3为弱酸,生成两种强酸:H2SO4和HCl,c(H+)增大,H2SO3反应完毕,消耗 Cl20.02mol,Cl2过量0.01mol,然后再氧化Br-,
Cl2 + 2HBr=Br2+2HCl
0.01mol 0.02mol
HBr全部转变为HCl,c(H+)不变,故A正确;
答案:A


科目:高中化学 来源: 题型:
【题目】设阿伏伽德罗常数为NA。则下列说法正确的是( )
A.常温常压下,6g![]() He所含有的中子数目为2NA
He所含有的中子数目为2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子个数为0.6mol.
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含有少量NaCl、 Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。

(1)沉淀A的主要成分是_____________、______________(填化学式)。
(2)①②③中均进行的分离操作是_______________。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是__________,为了除去杂质,可向溶液3中加入适量的______________。
(4)实验探究小组在实验中需要用到456 mL1 molL-1的HNO3溶液,但是在实验室中只发现一瓶8 molL-1的HNO3溶液,该小组用8molL-1的HNO3溶液配制所需溶液。
①实验中所需的玻璃仪器包括________、_____mL量筒、烧杯、________、胶头滴管等。
②该实验中需要量取8molL-1的HNO3溶液________mL。
③下列实验操作中导致配制的溶液浓度偏高的是_____________。
A.取用8molL-1的HNO3溶液溶液时仰视量筒刻度线
B.量取用的量筒水洗后未进行任何操作
C.8molL-1的HNO3溶液从量筒转移至烧杯后用水洗涤量筒并全部转移至烧杯
D.定容时仰视刻度线
E.定容后,将容量瓶振荡摇匀后,发现液面低于刻度线,未进行任何操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为组成人体细胞的主要的元素及其比例。下列相关叙述中,错误的是( )

A.图中所示为细胞鲜重中主要的元素的所占比例
B.因为 O 的含量最多,所以 O 是构成有机物的最基本元素
C.细胞失去大部分水分后,C 的所占比例最大
D.图中所示的元素在非生物界也可以找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中滴加
溶液中滴加![]() 的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是( )
的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是( )
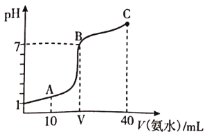
A. HA的电离方程式为![]()
B. B点时加入HA和氨水恰好完全反应
C. A点所示溶液中:![]()
D. C点所示溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别物质的方法中,不正确的是( )
A.用KSCN溶液鉴别FeCl2和FeCl3溶液
B.用澄清石灰水鉴别NaHCO3和Na2CO3
C.用焰色反应鉴别NaCl溶液和KCl溶液
D.用过量的NaOH溶液鉴别AlCl3溶液和MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水蕴含着丰富的资源。在化学实验室里模拟从海水中提取重要的工业原料时,设计了以下操作流程:
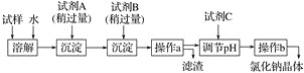
请回答以下问题:
(1)在所提供的试剂中选择:试剂B是____。
①Na2CO3 ②BaCl2 ③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、____、三脚架和玻璃棒。

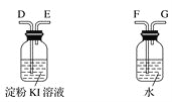
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按上图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:
A接___,___接____;B接____,____接____。
(4)电解氯化钠溶液时的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL,4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:

(1)BC对应反应的离子方程式为____________;
(2)运用高中阶段方法检验B点溶液中阳离子,现象是__________________________
(3)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为_____________。
(4)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KNO3和Ba(NO3)2两种固体混合物试回答下列问题
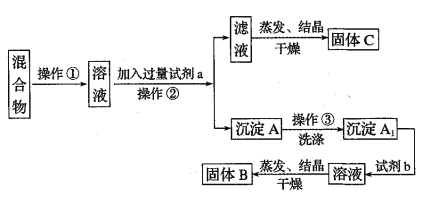
供选试剂:Na2SO4溶液、Na2CO3溶液、K2CO3溶液、K2SO4溶液、硫酸、硝酸
(1)试剂a是_______加入试剂b所发生反应的离子方程式为___________________________
(2)该方案能否达到实验目的:__________________________(填能或不能)若不能,应如何改进?__________________________(若能此问不用回答)
(3)若要测定原混合物中Ba(NO3)2的质量分数,除了要准确称量混合物的质量外至少还要获得的数据是__________的质量
(4)用所制备的KNO3固体配制0.1 mol/L KNO3溶液450mL,回答下列问题:
①配制过程中需要用到的玻璃仪器有烧杯、量筒、胶头滴管、______________
②需要用托盘天平称量_______g KNO3固体)
③下列情况会使所配溶液浓度偏低的是________
A.称量固体时,砝码与药品的位置放反了,即“左码右物”
B.使用有少量蒸馏水的容量瓶
C.定容时俯视刻度线观察液面
D.洗涤和转移时有液体外溅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com