
【题目】常温下,向![]() 溶液中滴加
溶液中滴加![]() 的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是( )
的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是( )
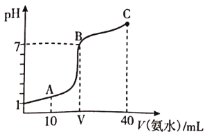
A. HA的电离方程式为![]()
B. B点时加入HA和氨水恰好完全反应
C. A点所示溶液中:![]()
D. C点所示溶液中:![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将一定量的Fe、Fe2O3、CuO的混合物放入体积为l00mL、浓度为2.2mol·L-1的H2SO4溶液中,充分反应后,生成气体 896mL(标况),得到不溶固体1.28 g,过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为 100mL)。向滤液中滴加 2mol·L-1的 NaOH溶液至40mL时开始出现沉淀。则未滴加 NaOH溶液前,滤液中 FeSO4的物质的量浓度为
A.2 mol·L-1B.l.8 mol·L-1C.1.9 mol·L-1D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Cu-Zn原电池示意图,下列叙述正确的是

A. 锌为负极,发生还原反应
B. 铜为负极,铜片上有气泡产生
C. 电子由铜片通过导线流向锌片
D. 溶液中的H+从铜片获得电子被还原成氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是()
A.0.01mol·L﹣1NH4Al(SO4)2溶液与0.02mol·L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Al(OH)3↓+NH3·H2O
B.一定条件下,将0.5molN2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ·mol﹣1
2NH3(g)△H=﹣38.6kJ·mol﹣1
C.2H2(g)+O2(g)=2H2O(g)△H=﹣571.6kJ·mol﹣1,则H2的燃烧热为571.6kJ·mol﹣1
D.CO(g)的燃烧热是283.0kJ·mol﹣1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:

(1)生物大分子以__________为骨架,它们的基本单位都被称为单体,其中X被形容为“生命的燃料”,它是_______________,Ⅰ在小麦种子中主要是指_______________。
(2)A表示的元素有__________;Y和Z在组成成分上的区别是:Z特有的成分是_________和 _________________(填名称),细胞中含有碱基A、C和T的核苷酸有________种。
(3)Ⅳ结构多样性的原因从P分析是_____________________________________________。现有P若干个,在合成含有3条链的Ⅳ的过程中共产生200个水分子,则P的数目为 ______个。
(4)染色质(体)主要由_________和__________组成(填字母),染色质与染色体的关系是:___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.03molCl2缓缓通入含0.02molH2SO3和0.02molHBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变)( )
A.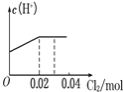 B.
B.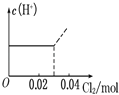
C.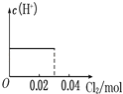 D.
D.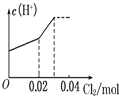
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,一定能大量共存的离子组是( )
A.常温下pH=13的无色溶液中能大量存在:Na+、Al3+、Cl-、MnO4-
B.与金属铝反应有大量气泡产生的溶液中:Zn2+、Mg2+、NO3-、Cl-
C.含有大量Fe3+的溶液中:SCN-、I-、Na+、Cl-
D.加入少量Na2O2后的溶液中:K+、Na+、SO42-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀硫酸与Ba(OH)2溶液混合:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁![]() 是一种补铁强化剂。实验室利用
是一种补铁强化剂。实验室利用![]() 与甘氨酸
与甘氨酸![]() 制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。

查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
I.装置C中盛有17.4g![]() 和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是________;与a相比,仪器b的优点是________。
(2)装置B中盛有的试剂是:_______;装置D的作用是________。
(3)向![]() 溶液中加入
溶液中加入![]() 溶液可制得
溶液可制得![]() ,该反应的离子方程式为________。
,该反应的离子方程式为________。
(4)过程I加入柠檬酸促进![]() 溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
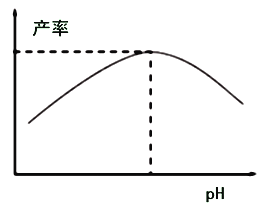
①pH过低或过高均导致产率下降,pH过高导致产率下降其原因是________;
②柠檬酸的作用还有________。
(5)过程II中加入无水乙醇的目的是________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是_______%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com