
【题目】在下列溶液中,一定能大量共存的离子组是( )
A.常温下pH=13的无色溶液中能大量存在:Na+、Al3+、Cl-、MnO4-
B.与金属铝反应有大量气泡产生的溶液中:Zn2+、Mg2+、NO3-、Cl-
C.含有大量Fe3+的溶液中:SCN-、I-、Na+、Cl-
D.加入少量Na2O2后的溶液中:K+、Na+、SO42-、CO32-
【答案】D
【解析】
A.溶液pH=13,显碱性;
B.与金属铝反应有大量气泡产生的溶液,为非氧化性酸或强碱溶液;
C.离子之间发生络合反应,生成络合物,同时离子之间发生氧化还原反应;
D.![]() 加入溶液中发生反应溶质显碱性。
加入溶液中发生反应溶质显碱性。
A.无色溶液中,不存在![]() ,pH=13的无色溶液显碱性,不能大量存在
,pH=13的无色溶液显碱性,不能大量存在 ![]() , 故A不选;
, 故A不选;
B.与金属铝反应有大量气泡产生的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在![]() ,酸溶液中
,酸溶液中![]() 发生氧化还原反应不生成氢气,故B 不选;
发生氧化还原反应不生成氢气,故B 不选;
C.![]() 结合生成络离子,
结合生成络离子,![]() 发生氧化还原反应,不能共存,故C 不选;
发生氧化还原反应,不能共存,故C 不选;
D.![]() 加入溶液中发生反应,生成氢氧化钠,溶液显碱性,该组离子之间不反应,可大量共存,故D正确;
加入溶液中发生反应,生成氢氧化钠,溶液显碱性,该组离子之间不反应,可大量共存,故D正确;
故答案为D 。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】下图是硫酸试剂瓶标签上的内容。请回答下列问题:
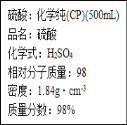
(1)该硫酸的物质的量浓度为____;
(2)实验室用该硫酸配制240mL0.46 mol·L-1的稀硫酸,则
①需要用量筒量取该硫酸的体积为_____mL;
②实验所用到的玻璃仪器除烧杯、玻璃棒外,还有_____;
③该同学实际配制得到的浓度为0.45 mol·L-1,可能的原因是_______。
A.量取浓H2SO4时仰视刻度 B.容量瓶洗净后未经干燥处理
C.没有将洗涤液转入容量瓶 D.定容时仰视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯无水![]() 是电解法制镁的关键原料,有化工人员开发了以菱镁矿(主要成分是
是电解法制镁的关键原料,有化工人员开发了以菱镁矿(主要成分是![]() ,含少量
,含少量![]() 杂质)为原料,以乙二醇为溶剂,采用氨络合法制备
杂质)为原料,以乙二醇为溶剂,采用氨络合法制备![]() (白色块状固体或粉末,溶于水,易潮解),再转化为无水
(白色块状固体或粉末,溶于水,易潮解),再转化为无水![]() 的新工艺,其流程图如图:
的新工艺,其流程图如图:
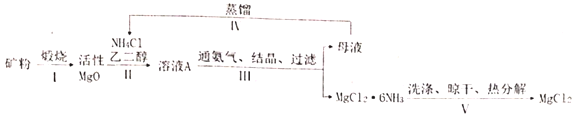
已知:①常压下,![]() 的初始分解温度为399℃,
的初始分解温度为399℃,![]() 的初始分解温度为896℃;
的初始分解温度为896℃;
②煅烧温度是影响MgO活性的关键因素;
③乙二醇的沸点197.3℃。
(1)步骤Ⅰ中工业上一般不选择800℃以上来完成这一步原因是_____。
(2)步骤Ⅱ中反应方程式为_____。
(3)步骤IV中蒸馏的目的是____。
(4)步骤V中的洗涤是为了除去晶体表面的杂质,最好选用下列哪种作为洗涤剂____。
A.氯化铵饱和溶液 B.乙二醇
C.冷水 D.氨气饱和的乙醇溶液
(5)实验过程需要测定![]() 浓度,可通过EDTA滴定(与
浓度,可通过EDTA滴定(与![]() 以1:1反应)来进行测定,若分下列步骤(未按顺序排列),为获得更可靠的实验结果,完整的操作顺序是c→___→e(用操作步骤前的字母表示)。
以1:1反应)来进行测定,若分下列步骤(未按顺序排列),为获得更可靠的实验结果,完整的操作顺序是c→___→e(用操作步骤前的字母表示)。
a.移取25.00mL待测溶液于锥形瓶中,加入10mL水,摇匀
b.用0.1000mol/L的EDTA标准溶液滴定至终点,记录消耗标准液的体积
c.称取一定质量的样品,配制250mL待测溶液
d.滴加1-2滴指示剂
e.舍弃不可靠数据、取平均值等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中滴加
溶液中滴加![]() 的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是( )
的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是( )
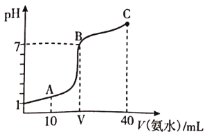
A. HA的电离方程式为![]()
B. B点时加入HA和氨水恰好完全反应
C. A点所示溶液中:![]()
D. C点所示溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是( )
A.1molFe与足量的Cl2反应转移的电子数为2NA
B.标准状况下,22.4L H2O中含有的分子数为NA
C.常温、常压下,39gNa2O2中含有的离子总数为1.5NA
D.1.0mol/L NaOH溶液中含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水蕴含着丰富的资源。在化学实验室里模拟从海水中提取重要的工业原料时,设计了以下操作流程:
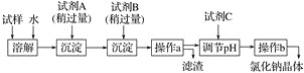
请回答以下问题:
(1)在所提供的试剂中选择:试剂B是____。
①Na2CO3 ②BaCl2 ③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、____、三脚架和玻璃棒。

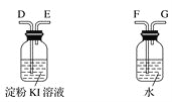
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按上图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:
A接___,___接____;B接____,____接____。
(4)电解氯化钠溶液时的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清溶液含有下列离子中的5种(忽略水的电离及离子的水解),K+、Na+、Ag+、Cu2+、Al3+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等.为探究溶液中离子组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
④另取溶液倒入足量的高浓度氢氧化钠,无明显现象,后再加入适量盐酸有白色絮状物生成。根据上述实验,以下推测正确的是( )
A.溶液中无法确定NO3-的存在B.原溶液中不含的离子为:K+、Ag+、Cu2+、CO32-
C.步骤①中可以确定Na+的存在D.步骤③中共有2种钡盐沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论正确的是
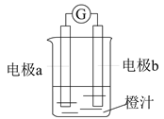
A. 原电池是将电能转化成化学能的装置
B. 实验探究中,活泼性强的金属做正极,活泼性弱的金属做负极
C. 上图中a极为锌片、b极为镁条时,导线中会产生电流
D. 上图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列判断正确的是( )
A.4.8g金属镁变为Mg2+时失去的电子数为0.2NA
B.6.2gNa2O中含有的阴离子数为0.1NA
C.1molCl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com