
【题目】高纯无水![]() 是电解法制镁的关键原料,有化工人员开发了以菱镁矿(主要成分是
是电解法制镁的关键原料,有化工人员开发了以菱镁矿(主要成分是![]() ,含少量
,含少量![]() 杂质)为原料,以乙二醇为溶剂,采用氨络合法制备
杂质)为原料,以乙二醇为溶剂,采用氨络合法制备![]() (白色块状固体或粉末,溶于水,易潮解),再转化为无水
(白色块状固体或粉末,溶于水,易潮解),再转化为无水![]() 的新工艺,其流程图如图:
的新工艺,其流程图如图:
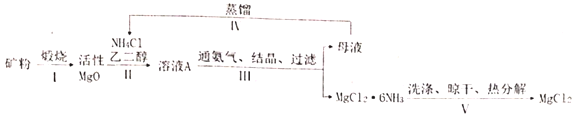
已知:①常压下,![]() 的初始分解温度为399℃,
的初始分解温度为399℃,![]() 的初始分解温度为896℃;
的初始分解温度为896℃;
②煅烧温度是影响MgO活性的关键因素;
③乙二醇的沸点197.3℃。
(1)步骤Ⅰ中工业上一般不选择800℃以上来完成这一步原因是_____。
(2)步骤Ⅱ中反应方程式为_____。
(3)步骤IV中蒸馏的目的是____。
(4)步骤V中的洗涤是为了除去晶体表面的杂质,最好选用下列哪种作为洗涤剂____。
A.氯化铵饱和溶液 B.乙二醇
C.冷水 D.氨气饱和的乙醇溶液
(5)实验过程需要测定![]() 浓度,可通过EDTA滴定(与
浓度,可通过EDTA滴定(与![]() 以1:1反应)来进行测定,若分下列步骤(未按顺序排列),为获得更可靠的实验结果,完整的操作顺序是c→___→e(用操作步骤前的字母表示)。
以1:1反应)来进行测定,若分下列步骤(未按顺序排列),为获得更可靠的实验结果,完整的操作顺序是c→___→e(用操作步骤前的字母表示)。
a.移取25.00mL待测溶液于锥形瓶中,加入10mL水,摇匀
b.用0.1000mol/L的EDTA标准溶液滴定至终点,记录消耗标准液的体积
c.称取一定质量的样品,配制250mL待测溶液
d.滴加1-2滴指示剂
e.舍弃不可靠数据、取平均值等
【答案】温度过高碳酸钙易分解、温度过高影响氧化镁的活性 ![]() 蒸馏除去母液中的水,使得乙二醇和氯化铵能循环利用 D c→a→d→b(重复“a→d→b”2-3次)→e
蒸馏除去母液中的水,使得乙二醇和氯化铵能循环利用 D c→a→d→b(重复“a→d→b”2-3次)→e
【解析】
此题是根据先将矿粉煅烧生成活性氧化镁,让活性氧化镁生成氯化镁,再利用氨络合生成MgCl2![]() 6H2O,洗涤晾干生成氯化镁,据此解答。
6H2O,洗涤晾干生成氯化镁,据此解答。
(1)由于碳酸钙高温下易分解,容易杂质,且温度过高影响氧化镁的活性,所以步骤Ⅰ中工业上一般不选择800℃以上来完成;
(2)根据工业流程中,进行氨络合反应可知,步骤Ⅱ是氧化镁和氯化铵反应,所以方程式为MgO+2NH4Cl=MgCl2+2NH3+H2O;
(3)因为步骤Ⅲ通入氨气使MgCl2转化为难溶于乙二醇的MgCl2·6NH3固体,过滤,滤液中含有可循环利用的NH4Cl和乙二醇,为防止NH4Cl受热分解,采用蒸馏去水、浓缩溶液方式得到浓度较大的乙二醇、NH4Cl的溶液,循环到步骤Ⅱ中充分利用;
(4)MgCl2·6NH3难溶于乙二醇,能溶于水,为减少洗涤过程中的损耗,不选用氯化铵饱和溶液和水洗涤,故AC不选;MgCl2·6NH3存在可逆反应:MgCl2+6NH3![]() MgCl2·6NH3,MgCl2能溶于乙二醇,选择含有氨气的饱和乙醇溶液,还能抑制MgCl2·6NH3分解,更加能减少损耗,故选D;
MgCl2·6NH3,MgCl2能溶于乙二醇,选择含有氨气的饱和乙醇溶液,还能抑制MgCl2·6NH3分解,更加能减少损耗,故选D;
(5)通过EDTA滴定(与Mg2+以1:1反应)来进行Mg2+浓度测定,为减小实验误差,重复滴定操作2~3次,取平均值进行计算,所以其实验步骤为:称取一定质量的样品→配制成溶液→移取一定量的待测液与锥形瓶→滴加1~2滴指示剂→用EDTA标准溶液滴定至终点,记录消耗标准液体积→重复滴定操作2~3次→数据处理,因此完整的操作顺序是c→a→d→b(重复“a→d→b”2~3次)→e。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,4.48LCl2通入水中,转移电子数为0.2NA
B.273K、101kPa下,28g乙烯与丙烯混合物中含有C—H键的数目为4NA
C.1L 0.1mol/L Na2SO4溶液中含有的氧原子数为0.4NA
D.1molL-1CH3COOH与1molL-1CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。下列关于KNO3的古代文献,对其说明不合理的是
选项 | 目的 | 古代文献 | 说明 |
A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,则祸不可测”——《天工开物》 | KNO3能自燃 |
B | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4);“强烧之,紫青烟起,云是硝石也”——《本草经集注》 | 利用焰色反应 |
C | 提纯 | “(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”——《开宝本草》 | 溶解,蒸发结晶 |
D | 性质 | “(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”——《本草纲目》 | 利用KNO3的氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Cu-Zn原电池示意图,下列叙述正确的是

A. 锌为负极,发生还原反应
B. 铜为负极,铜片上有气泡产生
C. 电子由铜片通过导线流向锌片
D. 溶液中的H+从铜片获得电子被还原成氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化-碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9kJ/mol Ea1=3.2kJ/mol
NO2(g)+O2(g) △H1=-200.9kJ/mol Ea1=3.2kJ/mol
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2=58kJ/mol
SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2=58kJ/mol
已知该体系中温度80℃以上臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:
3O2(g)。请回答:
(1)已知反应Ⅰ在低温下自发进行,则该反应的熵变△S___0(填“大于”或“小于”)。
(2)其它条件不变,每次向反应器中充入含1.0molNO、1molSO2的模拟烟气和2.0molO3,改变温度,反应相同时间后体系中NO和SO2的转化率如图所示:
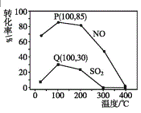
①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因___。
②100℃、反应相同时间t时O3的分解率达10%,则体系中剩余O3的物质的量是___mol。
③下列法正确的是___。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
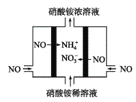
(3)工业上可以通过电解NO制备NH4NO3,原理如图所示。写出电解过程阳极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是()
A.0.01mol·L﹣1NH4Al(SO4)2溶液与0.02mol·L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Al(OH)3↓+NH3·H2O
B.一定条件下,将0.5molN2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ·mol﹣1
2NH3(g)△H=﹣38.6kJ·mol﹣1
C.2H2(g)+O2(g)=2H2O(g)△H=﹣571.6kJ·mol﹣1,则H2的燃烧热为571.6kJ·mol﹣1
D.CO(g)的燃烧热是283.0kJ·mol﹣1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:

(1)生物大分子以__________为骨架,它们的基本单位都被称为单体,其中X被形容为“生命的燃料”,它是_______________,Ⅰ在小麦种子中主要是指_______________。
(2)A表示的元素有__________;Y和Z在组成成分上的区别是:Z特有的成分是_________和 _________________(填名称),细胞中含有碱基A、C和T的核苷酸有________种。
(3)Ⅳ结构多样性的原因从P分析是_____________________________________________。现有P若干个,在合成含有3条链的Ⅳ的过程中共产生200个水分子,则P的数目为 ______个。
(4)染色质(体)主要由_________和__________组成(填字母),染色质与染色体的关系是:___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,一定能大量共存的离子组是( )
A.常温下pH=13的无色溶液中能大量存在:Na+、Al3+、Cl-、MnO4-
B.与金属铝反应有大量气泡产生的溶液中:Zn2+、Mg2+、NO3-、Cl-
C.含有大量Fe3+的溶液中:SCN-、I-、Na+、Cl-
D.加入少量Na2O2后的溶液中:K+、Na+、SO42-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成化合物Z。下列说法中正确的是( )
A. Z是共价化合物
B. Z可表示为M2Y
C. Z的电子式可表示为 ![]()
D. M形成+2价阳离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com