
【题目】燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化-碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9kJ/mol Ea1=3.2kJ/mol
NO2(g)+O2(g) △H1=-200.9kJ/mol Ea1=3.2kJ/mol
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2=58kJ/mol
SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2=58kJ/mol
已知该体系中温度80℃以上臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:
3O2(g)。请回答:
(1)已知反应Ⅰ在低温下自发进行,则该反应的熵变△S___0(填“大于”或“小于”)。
(2)其它条件不变,每次向反应器中充入含1.0molNO、1molSO2的模拟烟气和2.0molO3,改变温度,反应相同时间后体系中NO和SO2的转化率如图所示:
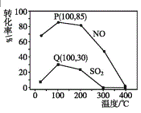
①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因___。
②100℃、反应相同时间t时O3的分解率达10%,则体系中剩余O3的物质的量是___mol。
③下列法正确的是___。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
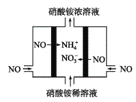
(3)工业上可以通过电解NO制备NH4NO3,原理如图所示。写出电解过程阳极的电极反应式___。
【答案】小于 反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应 0.65 BCD NO-3e-+2H2O=NO3-+4H+
【解析】
(1)根据G=△H-T△S<0,反应能够自发进行,结合低温下自发进行分析判断;
(2)①反应的活化能越小,反应越容易进行;②根据图像,反应Ⅰ中NO转化率为85%,反应Ⅱ中SO2的转化率30%,2O3(g)3O2(g),发生分解反应的臭氧占充入臭氧总量的10%,据此分析计算体系中剩余O3的物质的量;③该图象中属于描点法所得图象,P点不一定为图象的最高点;温度高于200°C,臭氧分解的程度加大,体系臭氧浓度减小;若缩小反应器的容积,2O3(g)3O2(g),平衡逆向进行,臭氧浓度增大;二氧化硫属于酸性氧化物,据此分析判断;
(3)工业上电解NO制备 NH4NO3,阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,据此分析书写电极反应式。
(1)反应I:NO(g)+O3(g)NO2(g)+O2(g)△H1=-200.9kJ/mol为放热反应,即△H<0,又在低温下自发进行,根据G=△H-T△S<0自发可知,△S小于0,故答案为:小于;
(2)①反应Ⅰ:NO(g)+O3(g )NO2(g)+O2(g)△H1=-200.9kJmol-1 Ea1=3.2kJmol-1,反应Ⅱ:SO2(g)+O3(g)SO3(g)+O2(g)△H2=-241.6kJmol-1 Ea2=58kJmol-1,反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,因此,相同温度下,NO的转化率远高于SO2,故答案为:反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应;
②根据图像,反应Ⅰ:NO(g)+O3(g)NO2(g)+O2(g)△H1=-200.9kJmol-1 Ea1=3.2kJmol-1,反应中NO转化率为85%,反应的NO为0.85mol,反应的O3为0.85mol;反应Ⅱ:SO2(g)+O3(g)SO3(g)+O2(g)△H2=-241.6kJmol-1 Ea2=58kJmol-1,反应中SO2的转化率30%,反应的二氧化硫0.3mol,反应的O3为0.3mol;2O3(g)3O2(g),发生分解反应的臭氧占充入臭氧总量的10%,为0.2mol;则体系中剩余O3的物质的量=2.0mol-0.85mol-0.3mol-0.2mol=0.65mol,故答案为:0.65;
③A.该图象属于描点法所得图象,P点不一定为图象的最高点,不一定为平衡点,可能是建立平衡状态过程中的一点,故A错误;B.根据图象可知,温度高于200°C,2O3(g)3O2(g),反应进行程度加大,体系中臭氧浓度迅速减小,NO、SO2的转化率随温度升高显著降低,当臭氧完全分解,则二者转化率几乎为0,故B正确;C.其它条件不变,若缩小反应器的容积,2O3(g)3O2(g),平衡逆向进行,臭氧浓度增大,反应Ⅰ和反应Ⅱ的平衡均正向移动,NO和SO2的转化率增大,故C正确;D.根据图像,臭氧氧化过程中二氧化硫的转化率较低,不能有效地脱除SO2,二氧化硫属于酸性氧化物,可以和碱之间发生反应,后续步骤碱吸收可以有效脱硫,故D正确;故答案为:BCD;
(3)工业上电解NO制备 NH4NO3,由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,故答案为:NO-3e-+2H2O=NO3-+4H+。


科目:高中化学 来源: 题型:
【题目】某同学欲配制480 mL物质的量浓度为0.1mol·L-1的CuSO4溶液。
(1)完成该实验用到的仪器主要有:托盘天平、胶头滴管、烧杯、玻璃棒、药匙和____________。
(2)写出整个实验简单的操作过程:计算→称量→溶解→转移→____________→定容→摇匀。
(3)如果用CuSO4固体来配制,应该称量固体的质量为_________________;如果用CuSO4·5H2O来配制,应该称量固体的质量为____________________。
(4)下列操作使配制的溶液浓度偏低的是__________________。
A.配制的过程中有少量的液体溅出烧杯。
B.使用前容量瓶用蒸馏水洗涤,且没有干燥。
C.定容时俯视液面。
D.定容摇匀后,液面下降,又加水至刻度线。
(5)取配制好的溶液50 mL用水稀释到100 mL所得溶液中Cu2+的物质的量浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一密闭容器中盛有甲烷,在隔绝空气条件下长时间加热到1000℃左右(假使甲烷完全分解),然后恢复至室温(20℃)。这时容器内气体的压强是原来甲烷压强的m倍,原来甲烷的密度是容器内气体密度的n倍。下列判断正确的是( )
A.m=2,n=0.25B.m=0.5,n=4C.m=2,n=4D.m=0.5,n=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是常见的解热镇痛药,结构简式如图所示,有关阿司匹林的说法不正确的是( )
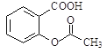
A.能发生水解、酯化、取代、还原反应
B.阿司匹林分子中最多可以有20个原子在同一平面上
C.1mol该物质完全氧化最多可消耗9mol氧气
D.1mol该物质最多可与3molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为
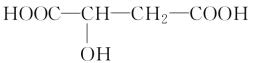
下列相关说法不正确的是( )。
A.苹果酸在一定条件下能发生酯化反应
B.苹果酸在一定条件下能发生催化氧化反应
C.1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下)
D.1 mol苹果酸与Na2CO3溶液反应一定消耗2 mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
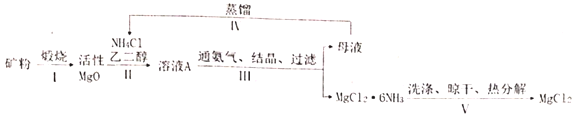
【题目】高纯无水![]() 是电解法制镁的关键原料,有化工人员开发了以菱镁矿(主要成分是
是电解法制镁的关键原料,有化工人员开发了以菱镁矿(主要成分是![]() ,含少量
,含少量![]() 杂质)为原料,以乙二醇为溶剂,采用氨络合法制备
杂质)为原料,以乙二醇为溶剂,采用氨络合法制备![]() (白色块状固体或粉末,溶于水,易潮解),再转化为无水
(白色块状固体或粉末,溶于水,易潮解),再转化为无水![]() 的新工艺,其流程图如图:
的新工艺,其流程图如图:
已知:①常压下,![]() 的初始分解温度为399℃,
的初始分解温度为399℃,![]() 的初始分解温度为896℃;
的初始分解温度为896℃;
②煅烧温度是影响MgO活性的关键因素;
③乙二醇的沸点197.3℃。
(1)步骤Ⅰ中工业上一般不选择800℃以上来完成这一步原因是_____。
(2)步骤Ⅱ中反应方程式为_____。
(3)步骤IV中蒸馏的目的是____。
(4)步骤V中的洗涤是为了除去晶体表面的杂质,最好选用下列哪种作为洗涤剂____。
A.氯化铵饱和溶液 B.乙二醇
C.冷水 D.氨气饱和的乙醇溶液
(5)实验过程需要测定![]() 浓度,可通过EDTA滴定(与
浓度,可通过EDTA滴定(与![]() 以1:1反应)来进行测定,若分下列步骤(未按顺序排列),为获得更可靠的实验结果,完整的操作顺序是c→___→e(用操作步骤前的字母表示)。
以1:1反应)来进行测定,若分下列步骤(未按顺序排列),为获得更可靠的实验结果,完整的操作顺序是c→___→e(用操作步骤前的字母表示)。
a.移取25.00mL待测溶液于锥形瓶中,加入10mL水,摇匀
b.用0.1000mol/L的EDTA标准溶液滴定至终点,记录消耗标准液的体积
c.称取一定质量的样品,配制250mL待测溶液
d.滴加1-2滴指示剂
e.舍弃不可靠数据、取平均值等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均为常见物质或它们的溶液,其中 A为淡黄色固体, C、X 均为无色气体,Z为浅绿色溶液,D为一种常见的强碱,F物质不溶于水。根据它们之间的转化关系(下图),回答下列问题:
(部分反应物与产物已省略)
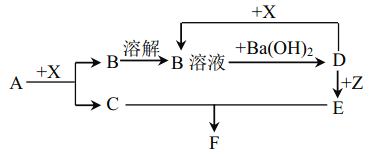
(1)写出下列物质的化学式:X____________ F______________
(2)向Z 溶液中通入足量的Cl2,写出检验所得溶液中阳离子所需试剂_______________________。
(3)向含 10g D 的溶液中通入一定量的 X,完全反应后,在低温条件下蒸发结晶,最终得到 14.8g 固体。
①简述蒸发结晶在低温条件下进行的理由:____________________________________________________(用必要的文字回答)
②所得固体中含有的物质及其它们的物质的量之比为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是( )
A.1molFe与足量的Cl2反应转移的电子数为2NA
B.标准状况下,22.4L H2O中含有的分子数为NA
C.常温、常压下,39gNa2O2中含有的离子总数为1.5NA
D.1.0mol/L NaOH溶液中含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
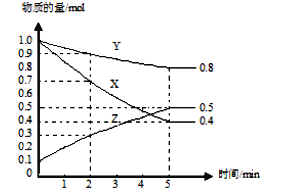
(1)该反应的化学方程式是_____________________________。
(2)该反应达到平衡状态的标志是________(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1 mol Y的同时消耗2 mol Z
(3)计算2 min内,Y的转化率为_____________;用物质X表示反应的平均速率为___________;用物质Z表示反应的平均速率为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com