
ΓΨΧβΡΩΓΩΩ’Φδ Β―ι “ΓΑΧλΙ§“ΜΚ≈Γ±ΒΡΙ©ΒγœΒΆ≥÷–”–‘Ό…ζ«β―θ»ΦΝœΒγ≥ΊΘ®RFCΘ©Θ§RFC «“Μ÷÷ΫΪΥ°ΒγΫβΦΦ θ”κ«β―θ»ΦΝœΒγ≥ΊΦΦ θœύΫαΚœΒΡΩ…≥δΒγΒγ≥ΊΓΘœ¬ΆΦΈΣRFCΙΛΉς‘≠άμ Ψ“βΆΦΘ§”–ΙΊΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©

AΘ°ΉΣ“Τ0Θ°1molΒγΉ” ±Θ§aΒγΦΪ≤ζ…ζ1Θ°12LH2ΓΘ
BΘ°bΒγΦΪ…œΖΔ…ζΒΡΒγΦΪΖ¥”Π «ΘΚ2H2O+2eΘ≠ΘΫH2Γϋ+2OHΘ≠
CΘ°cΒγΦΪ…œΖΔ…ζΜΙ‘≠Ζ¥”ΠΘ§BΒγ≥Ί÷–ΒΡH+Ω…“‘Ά®ΙΐΗτΡΛΫχ»κA≥Ί
DΘ°dΒγΦΪ…œΖΔ…ζΒΡΒγΦΪΖ¥”Π «ΘΚO2+4HΘΪ+4eΘ≠ΘΫ2H2O
ΓΨ¥πΑΗΓΩC
ΓΨΫβΈωΓΩ
‘ΧβΖ÷ΈωΘΚ“άΨίΆΦ Ψ÷ΣΉσ±ΏΉΑ÷Ο «ΒγΫβ≥ΊΘ§”“±ΏΉΑ÷Ο «‘≠Βγ≥ΊΘ§aΚΆbΒγΦΪ «ΒγΫβ≥ΊΒΡΒγΦΪΘ§”…Βγ‘¥≈–ΕœaΈΣ“θΦΪ≤ζ…ζΒΡΤχΧε ««βΤχΘ§bΈΣ―τΦΪ≤ζ…ζΒΡΤχΧε «―θΤχΘΜcΚΆdΒγΦΪ «‘≠Βγ≥ΊΒΡ’ΐΗΚΦΪΘ§c «’ΐΦΪΘ§d «ΗΚΦΪΘΜΒγΫβ≥Ί÷–ΒΡΒγΦΪΖ¥”ΠΈΣΘΚbΒγΦΪΈΣ―τΦΪ ßΒγΉ”ΖΔ…ζ―θΜ·Ζ¥”ΠΘΚ4OH - -4e - ΘΫ2H 2 O+O 2 ΓϋΘΜaΒγΦΪΈΣ“θΦΪΒΟΒΫΒγΉ”ΖΔ…ζΜΙ‘≠Ζ¥”ΠΘΚ4H + +4e - ΘΫ2H 2 ΓϋΘΜ‘≠Βγ≥Ί÷– «Υα–‘»ή“ΚΘ§ΒγΦΪΖ¥”ΠΈΣΘΚdΈΣΗΚΦΪ ßΒγΉ”ΖΔ…ζ―θΜ·Ζ¥”ΠΘΚ2H 2 -4e - ΘΫ4H + ΘΜcΒγΦΪΈΣ’ΐΦΪΒΟΒΫΒγΉ”ΖΔ…ζΜΙ‘≠Ζ¥”ΠΘΚO 2 +4H + +4e - ΘΫ2H 2 OΘ§‘ρA.ΟΜ”–±ξΩωœ¬ΧθΦΰΘ§A¥μΈσΘΜBΓΘbΈΣ―τΦΪ≤ζ…ζΒΡΤχΧε «―θΤχΘ§ ßΒγΉ”Θ§B≤Μ’ΐ»ΖΘΜCΓΔcΒγΦΪΈΣ’ΐΦΪΒΟΒΫΒγΉ”ΖΔ…ζΜΙ‘≠Ζ¥”ΠΘΚO 2 +4H + +4e - ΘΫ2H 2 OΘ§»ή“Κ÷–H+œρ’ΐΦΪ“ΤΕ·Θ§C’ΐ»ΖΘΜDΓΘ dΈΣΗΚΦΪ ßΒγΉ”ΖΔ…ζ―θΜ·Ζ¥”ΠΘΚ2H 2 -4e - ΘΫ4H + Θ§D¥μΈσΘΜ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ4÷÷œύΝΎ÷ςΉεΕΧ÷ήΤΎ‘ΣΥΊΒΡœύΕ‘ΈΜ÷Ο»γ±μ,‘ΣΥΊxΒΡ‘≠Ή”ΚΥΆβΒγΉ” ΐ «mΒΡ2±Ε,yΒΡ―θΜ·ΈοΨΏ”–ΝΫ–‘ΓΘ
m | n | ||
x | y |
ΜΊ¥πœ¬Ν–Έ Χβ:
Θ®1Θ©‘ΣΥΊx‘Ύ÷ήΤΎ±μ÷–ΒΡΈΜ÷Ο « ,ΤδΒΞ÷ Ω…≤…”ΟΒγΫβ»έ»Ύ ΒΡΖΫΖ®÷Τ±ΗΓΘ
Θ®2Θ©ΤχΧεΖ÷Ή”Θ®mnΘ©2ΒΡΒγΉ” ΫΈΣ ,Θ®mnΘ©2≥ΤΈΣΡ⬱պ,–‘÷ ”ꬱպœύΥΤ,Τδ”κ«β―θΜ·ΡΤ»ή“ΚΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ ΓΘ
Θ®3Θ©“―÷Σ«ηΜ·ΡΤΘ®NaCNΘ©,Ω…“‘”κΚήΕύΫπ τ–Έ≥…¬γΚœΈο,“ρ¥ΥΙΛ“Β…œ≤…”Ο«ηΜ·Ζ®ΧαΝΕΫπΘΚ”ΟœΓΒΡ«ηΜ·ΡΤ»ή“Κ¥ΠάμΖέΥιΝΥΒΡΫπΩσ ·,Ά®»κΩ’Τχ, ΙΫπΩσ ·÷–ΒΡΫπΝΘ»ήΫβ,…ζ≥…Ρή»ή”ΎΥ°ΒΡ¬γΚœΈοNa[AuΘ®CNΘ©2],ΤδΖ¥”ΠΖΫ≥Χ ΫΈΣ:ΔΌ4Au+8NaCN+2H2O+O2=4Na[AuΘ®CNΘ©2]+4NaOHΘ§Na[AuΘ®CNΘ©2]‘ΎΥ°»ή“Κ÷–ΒΡΒγάκΖΫ≥Χ ΫΈΣ:ΔΎNa[AuΘ®CNΘ©2]=Na++[AuΘ®CNΘ©2]-Θ§»ΜΚσ‘Ό”Ο–Ω¥”»ή“Κ÷–Α―Ϋπ÷ΟΜΜ≥ωά¥,–ΩΉΣΜ·ΈΣNa2[ZnΘ®CNΘ©4]ΓΘΨί¥ΥΘ§«κάϊ”ΟΔΌ–¥≥ω‘ΎΩ’Τχ÷–”Ο«ηΜ·ΡΤ»ή“ΚΧα»ΓΫπΒΡΒγΦΪΖ¥”Π Ϋ:’ΐΦΪ: Θ§ΗΚΦΪ: ΓΘ
Θ®4Θ©»τ»Υ≤Μ…ς«ηΜ·ΡΤ÷–ΕΨ,Ω…”ΟNa2S2O3ΜΚΫβ,Εΰ’ΏΖ¥”ΠΒΟΒΫΝΫ÷÷Κ§Νρ‘ΣΥΊΒΡάκΉ”,Τδ÷–“Μ÷÷”ωΒΫFe3+Ω…±δΈΣΚλ…ΪΓΘ–¥≥ωΫβΕΨ‘≠άμΒΡœύΙΊάκΉ”ΖΫ≥Χ Ϋ ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΘ®1Θ©“―÷Σ≥ΘΈ¬œ¬Θ§Ksp[Fe(OH)3]=4.0ΓΝ10-38Θ§‘ΎFeCl3»ή“Κ÷–Φ”»κNaHCO3»ή“Κ≤ζ…ζ≥ΝΒμΚΆΤχΧεΘ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ__________ΘΜ»τΫΪΥυΒΟ–ϋΉ«“ΚΒΡpHΒς’ϊΈΣ4Θ§‘ρ»ή“Κ÷–Fe3+≈®Ε»ΈΣ__________molL-1
Θ®2Θ©“―÷ΣΥ°¥φ‘Ύ»γœ¬ΤΫΚβΘΚH2OH++OH-ΓςHΘΨ0Θ§œ÷”ϊ ΙΤΫΚβœρ”““ΤΕ·Θ§«“ΥυΒΟ»ή“Κœ‘Φν–‘Θ§―Γ‘ώΖΫΖ® «__________Θ°
AΘ°œρΥ°÷–Φ”»κNaHSO4ΙΧΧε
BΘ°œρΥ°÷–Φ”Na2CO3ΙΧΧε
CΘ°Φ”»»÷Ν100Γφ[Τδ÷–c(H+)=1ΓΝ10-6 molL-1]
DΘ°œρΥ°÷–Φ”»κNH4ClΙΧΧε
Θ®3Θ©≥ΘΈ¬œ¬Θ§≈®Ε»ΨυΈΣ0.1molL-1ΒΡœ¬Ν–Έε÷÷ΡΤ―Έ»ή“ΚΒΡpH»γœ¬±μΘΜ
»ή÷ | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
…œ ω―Έ»ή“Κ÷–ΒΡ“θάκΉ”Θ§ΫαΚœH+ΡήΝΠΉν«ΩΒΡ «__________Θ§ΗυΨί±μ÷– ΐΨίΘ§≈®Ε»ΨυΈΣ0.01molL-1ΒΡœ¬Ν–ΥΡ÷÷ΥαΒΡ»ή“ΚΖ÷±πœΓ Ά100±ΕΘ§pH±δΜ·Ήν¥σΒΡ «__________(Χν±ύΚ≈)Θ°
AΘ°HCN BΘ°HClO CΘ°CH3COOH DΘ°H2CO3
Θ®4Θ©œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «(Χν–ρΚ≈Γ≥____________ΓΘ
AΘ°Ρ≥Έ¬Ε»œ¬¥ΩΥ°÷–ΒΡc(H+)=10-6Θ§Ι Τδœ‘Υα–‘
BΘ°”ΟœΓ―ΈΥαœ¥Β”AgCl≥ΝΒμ±»”ΟΥ°œ¥Β”ΥπΚΡAgCl–Γ
CΘ°œύΆ§Έ¬Ε»œ¬Θ§0.1mol/LNH4Cl»ή“Κ÷–NH4+ΒΡ≈®Ε»±»0.1mol/LΑ±Υ°÷–NH4+ΒΡ≈®Ε»¥σ
DΘ°œύΆ§Έ¬Ε»œ¬pHΨυΈΣ8 ΒΡNa2CO3ΚΆNaHCO3»ή“ΚΘ§«Α’ΏΈο÷ ΒΡΝΩ≈®Ε»¥σ
EΘ°œρ±ΞΚΆ ·Μ“Υ°÷–Φ”»κCaOΙΧΧεΘ§»ή“Κ÷–Ca2+ΓΔOH-ΒΡΈο÷ ΒΡΝΩΨυΦθ–Γ
Θ®5Θ© Β―ι “÷–≥Θ”ΟNaOHά¥Ϋχ––œ¥ΤχΚΆΧα¥ΩΘ°Β±400mL 1molL-1ΒΡNaOH»ή“ΚΈϋ ’±ξΉΦΉ¥Ωωœ¬4.48LCO2 ±Θ§ΥυΒΟ»ή“Κ÷–ΗςάκΉ”≈®Ε»”…¥σΒΫ–ΓΒΡΥ≥–ρΈΣ__________Θ°
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–Ης«ιΩωΘ§‘ΎΤδ÷–FeΤ§Η· ¥”…ΩλΒΫ¬ΐΒΡΥ≥–ρ «( )
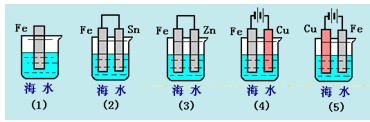
AΘ°(5)(2)(1)(3)(4) BΘ°(2)(5)(3)(4)(1)
CΘ°(5)(3)(4)(1)(2) DΘ°(1)(5)(3)(4)(2)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ―–ΨΩΦΉΉ¥œΌΙΠΡή ±”Π”ΟΒΡΖ≈…δ–‘Ά§ΈΜΥΊ «
A. 14C B. 131I C. 15N D. 90Sr
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΒΣΒΡΜ·ΚœΈοΚœ≥…ΓΔ”Π”ΟΦΑΒΣΒΡΙΧΕ®“Μ÷± «ΩΤ―ß―–ΨΩΒΡ»»ΒψΓΘ
Θ®1Θ©“‘CO2”κNH3ΈΣ‘≠ΝœΚœ≥…Μ·Ζ ΡρΥΊΒΡ÷ς“ΣΖ¥”Π»γœ¬ΘΚ
ΔΌ2NH3Θ®gΘ©ΘΪCO2Θ®gΘ©ΘΫNH2CO2NH4Θ®sΘ©ΘΜΠΛHΘΫΘ≠159.47 kJΓΛmolΘ≠1
ΔΎNH2CO2NH4Θ®sΘ©ΘΫCO Θ®NH2Θ©2Θ®sΘ©ΘΪH2OΘ®gΘ©ΘΜΠΛHΘΫa kJΓΛmolΘ≠1
Δέ2NH3Θ®gΘ©ΘΪCO2Θ®gΘ©ΘΫCOΘ®NH2Θ©2Θ®sΘ©ΘΪH2OΘ®gΘ©ΘΜΠΛHΘΫΘ≠86.98 kJΓΛmolΘ≠1‘ρaΈΣ ΓΘ
Θ®2Θ©Ζ¥”Π2NH3Θ®gΘ©ΘΪCO2Θ®gΘ©![]() COΘ®NH2Θ©2Θ®lΘ©ΘΪH2OΘ®gΘ© ‘ΎΚœ≥…Υΰ÷–Ϋχ––ΓΘœ¬ΆΦ÷–ΔώΓΔΔρΓΔΔσ»ΐΧθ«ζœΏΈΣΚœ≥…Υΰ÷–Α¥≤ΜΆ§Α±ΧΦ±» [nΘ®NH3Θ©/nΘ®CO2Θ©]ΚΆΥ°ΧΦ±»[nΘ®H2OΘ©/nΘ®CO2Θ©]ΆΕΝœ ±Εΰ―θΜ·ΧΦΉΣΜ·¬ ΒΡ«ιΩωΓΘ
COΘ®NH2Θ©2Θ®lΘ©ΘΪH2OΘ®gΘ© ‘ΎΚœ≥…Υΰ÷–Ϋχ––ΓΘœ¬ΆΦ÷–ΔώΓΔΔρΓΔΔσ»ΐΧθ«ζœΏΈΣΚœ≥…Υΰ÷–Α¥≤ΜΆ§Α±ΧΦ±» [nΘ®NH3Θ©/nΘ®CO2Θ©]ΚΆΥ°ΧΦ±»[nΘ®H2OΘ©/nΘ®CO2Θ©]ΆΕΝœ ±Εΰ―θΜ·ΧΦΉΣΜ·¬ ΒΡ«ιΩωΓΘ

ΔΌ«ζœΏΔώΓΔΔρΓΔΔσΥ°ΧΦ±»ΒΡ ΐ÷ΒΖ÷±πΈΣΘΚ
AΘ°0.6ΓΪ0.7 BΘ°1ΓΪ1.1 CΘ°1.5ΓΪ1.61
…ζ≤ζ÷–”Π―Γ”ΟΥ°ΧΦ±»ΒΡ ΐ÷ΒΈΣ Θ®―ΓΧν–ρΚ≈Θ©ΓΘ
ΔΎ…ζ≤ζ÷–Α±ΧΦ±»“ΥΩΊ÷Τ‘Ύ4.0Ήσ”“Θ§Εχ≤Μ «4.5ΒΡ‘≠“ρΩ…Ρή « ΓΘ
Θ®3Θ©ΡρΥΊΩ…”Ο”Ύ ΣΖ®―ΧΤχΆ―ΒΣΙΛ“’Θ§ΤδΖ¥”Π‘≠άμΈΣΘΚ
NOΘΪNO2ΘΪH2OΘΫ2HNO2ΘΜ2HNO2ΘΪCOΘ®NH2Θ©2ΘΫ2N2ΓϋΘΪCO2ΓϋΘΪ3H2OΓΘ
ΔΌΒ±―ΧΤχ÷–NOΓΔNO2Α¥…œ ωΖ¥”Π÷–œΒ ΐ±» ±Ά―ΒΣ–ßΙϊΉνΦ―ΓΘ»τ―ΧΤχ÷–VΘ®NOΘ©ΓΟVΘ®NO2Θ©ΘΫ5ΓΟ1 ±Θ§Ω…Ά®»κ“ΜΕ®ΝΩΒΡΩ’ΤχΘ§Ά§Έ¬Ά§―Ιœ¬Θ§VΘ®Ω’ΤχΘ©ΓΟVΘ®NOΘ©ΘΫ Θ®Ω’Τχ÷–―θΤχΒΡΧεΜΐΚ§ΝΩ¥σ‘ΦΈΣ20%Θ©ΓΘ
ΔΎΆΦ2 «ΡρΥΊΚ§ΝΩΕ‘Ά―ΒΣ–ß¬ ΒΡ”ΑœλΘ§¥”Ψ≠ΦΟ“ρΥΊ…œΩΦ¬«Θ§“ΜΑψ―Γ‘ώΡρΥΊ≈®Ε»‘ΦΈΣ %ΓΘ

Θ®4Θ©ΆΦ3±μ Ψ Ι”Ο–¬–ΆΒγΦΪ≤ΡΝœΘ§“‘N2ΓΔH2ΈΣΒγΦΪΖ¥”ΠΈοΘ§“‘HClΘ≠NH4ClΈΣΒγΫβ÷ »ή“Κ÷Τ‘λ≥ωΦ»ΡήΧαΙ©ΡήΝΩΘ§Ά§ ±”÷Ρή Βœ÷ΒΣΙΧΕ®ΒΡ–¬–Ά»ΦΝœΒγ≥ΊΓΘ«κ–¥≥ωΗΟΒγ≥ΊΒΡ’ΐΦΪΖ¥”Π Ϋ ΓΘ

≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣA(g)+B(g) ![]() C(g)+D(g)Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐΚΆΈ¬Ε»ΒΡΙΊœΒ»γœ¬ΘΚ
C(g)+D(g)Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐΚΆΈ¬Ε»ΒΡΙΊœΒ»γœ¬ΘΚ
Έ¬Ε»/ Γφ | 700 | 800 | 830 | 1000 | 1200 |
ΤΫΚβ≥Θ ΐ | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830Γφ ±Θ§œρ“ΜΗω2 LΒΡΟή±’»ίΤς÷–≥δ»κ0.2molΒΡAΚΆ0.8molΒΡBΘ§Ζ¥”Π≥θ Φ4 sΡΎAΒΡΤΫΨυΖ¥”ΠΥΌ¬ v(A)=0Θ°005 mol/(LΓΛs)ΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
AΘ°4 s ±c(B)ΈΣ0.76 mol/L
BΘ°830Γφ¥οΤΫΚβ ±Θ§AΒΡΉΣΜ·¬ ΈΣ80%
CΘ°Ζ¥”Π¥οΤΫΚβΚσΘ§…ΐΗΏΈ¬Ε»Θ§ΤΫΚβ’ΐœρ“ΤΕ·
DΘ°1200Γφ ±Ζ¥”ΠC(g)+D(g) ![]() A(g)+B(g)ΒΡΤΫΚβ≥Θ ΐΒΡ÷ΒΈΣ0.4
A(g)+B(g)ΒΡΤΫΚβ≥Θ ΐΒΡ÷ΒΈΣ0.4
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. Ρ≥»ή“Κ![]() …ζ≥…ΑΉ…Ϊ≥ΝΒμΘ§ΥΒΟς‘≠»ή“Κ÷–”–Cl-
…ζ≥…ΑΉ…Ϊ≥ΝΒμΘ§ΥΒΟς‘≠»ή“Κ÷–”–Cl-
B. Ρ≥»ή“Κ![]() …ζ≥…ΑΉ…Ϊ≥ΝΒμΘ§ΥΒΟς‘≠»ή“Κ÷–”–SO42-
…ζ≥…ΑΉ…Ϊ≥ΝΒμΘ§ΥΒΟς‘≠»ή“Κ÷–”–SO42-
C. Ρ≥»ή“Κ![]() …ζ≥…Έό…ΪΤχΧεΘ§ΥΒΟς‘≠»ή“Κ÷–”–CO32-
…ζ≥…Έό…ΪΤχΧεΘ§ΥΒΟς‘≠»ή“Κ÷–”–CO32-
D. Ρ≥»ή“Κ![]() …ζ≥…άΕ…Ϊ≥ΝΒμΘ§ΥΒΟς‘≠»ή“Κ÷–”–Cu2+
…ζ≥…άΕ…Ϊ≥ΝΒμΘ§ΥΒΟς‘≠»ή“Κ÷–”–Cu2+
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΗς÷÷œ¥Β”ΦΝΙψΖΚΫχ»κ»ΥΟ«ΒΡ…ζΜν÷–Θ§œ¬Ν–œ¥Β”÷–Υυ”Οœ¥Β”ΦΝΨΏ”–»ιΜ·ΙΠΡήΒΡ «
AΘ°”ΟΤϊ”Ά≥ΐ»Ξ“¬Ζΰ…œΒΡ”ΆΈέ
BΘ°”Ο≤ΆΨΏœ¥ΫύΨΪ«εœ¥≤ΆΨΏ…œΒΡ”ΆΈέ
CΘ°”ΟΥ°œ¥»Ξ≈ΧΉ”÷–ΒΡΥ°Ιϊ‘ϋ
DΘ°”Ο¥Ήœ¥»ΞΥ°ΚχΒΡΥ°ΙΗ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com