
【题目】已知A(g)+B(g) ![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76 mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4
【答案】B
【解析】
试题分析:A.反应初始4s内A的平均反应速率v(A)=0.005mol/(Ls),速率之比等于化学计量数之比,所以v(B)=v(A)=0.005mol/(Ls),则4s内△c(B)=0.005molL-1s-1×4s=0.02mol/L,B的起始浓度为![]() =0.4mol/L,故4s时c(B)=0.4mol/L-0.02mol/L=0.38mol/L,故A错误;B.设平衡时A的浓度变化量为x,则:
=0.4mol/L,故4s时c(B)=0.4mol/L-0.02mol/L=0.38mol/L,故A错误;B.设平衡时A的浓度变化量为x,则:
A(g)+B(g)![]() C(g)+D(g)
C(g)+D(g)
开始(mol/L):0.1 0.4 0 0
变化(mol/L):x x x x
平衡(mol/L):0.1-x 0.4-x x x
故![]() =1,解得x=0.08,所以平衡时A的转化率为
=1,解得x=0.08,所以平衡时A的转化率为![]() ×100%=80%,故B正确;C.由表格可知,温度升高,化学平衡常数减小,平衡逆向移动,不是正向移动,故C错误;D.1200℃时反应A(g)+B(g)C(g)+D(g)的平衡常数值为0.4,所以1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为
×100%=80%,故B正确;C.由表格可知,温度升高,化学平衡常数减小,平衡逆向移动,不是正向移动,故C错误;D.1200℃时反应A(g)+B(g)C(g)+D(g)的平衡常数值为0.4,所以1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为![]() =2.5,故D错误;故选B。
=2.5,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】
(1)写出下列仪器的名称:
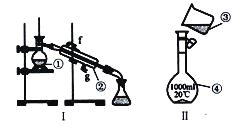
①__________________;②__________________;④__________________;
(2)仪器①~④中,使用时必须检査是否漏水的有_______________(填序号〉
(3)现需配制250 mL0.2mol/LNaCl溶液,装置II是某同学转移溶液的示意图,图中两处错误是_____________,___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程不用熵判据判断的是
A.氯化铵与结晶氢氧化钡混合研磨,很快会闻到刺激性气味
B.冬天一杯热水很快变冷
C.有序排列的火柴散落时成为无序排列
D.多次洗牌以后,扑克牌毫无规律的混乱排列的几率大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )

A.转移0.1mol电子时,a电极产生1.12LH2。
B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C.c电极上发生还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。
(1)下图是当反应器中按按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:

①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(s)和q (s)反应生成NO(g)过程中的能量变化,下列说法中正确的是

A.1mol N2(g)和1mol O2(g)反应放出的能量为180kJ
B.1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
C.在1L的容器中发生反应,10min内N2减少了1mol,因此10min内的平均反应速率v(NO)=0.1mol/(L·min)
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SF6是一种优良的绝缘气体,分子结构中存在S—F键。已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热ΔH为
A. -1220 kJ/mol B. -1780 kJ/mol C. -450 kJ/mol D. +430 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号中的试剂除去下列物质中的少量杂质,正确的是 ( )
A. 溴苯中的溴(KI溶液) B. 甲烷中的乙烯(溴水)
C. 乙酸乙酯中的乙酸(乙醇) D. 二氧化碳中的氯化氢(KOH溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com