
【题目】(1)已知常温下,Ksp[Fe(OH)3]=4.0×10-38,在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:__________;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为__________molL-1
(2)已知水存在如下平衡:H2OH++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是__________.
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 molL-1]
D.向水中加入NH4Cl固体
(3)常温下,浓度均为0.1molL-1的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是__________,根据表中数据,浓度均为0.01molL-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是__________(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(4)下列说法不正确的是(填序号〕____________。
A.某温度下纯水中的c(H+)=10-6,故其显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.相同温度下,0.1mol/LNH4Cl溶液中NH4+的浓度比0.1mol/L氨水中NH4+的浓度大
D.相同温度下pH均为8 的Na2CO3和NaHCO3溶液,前者物质的量浓度大
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小
(5)实验室中常用NaOH来进行洗气和提纯.当400mL 1molL-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________.
【答案】
(1)Fe3++3HCO3-═Fe(OH)3↓+3CO2↑;4.0×10-8;
(2)B;
(3)CO32-;C;
(4)AD
(5)C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+);
【解析】
试题分析:(1)NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体;反应的离子方程式为Fe3++3HCO3-═Fe(OH)3↓+3CO2↑,已知溶液pH=4,即c(H+)=10-4mol/L,则c(OH-)=10-10mol/L,已知Ksp[Fe(OH)3]=4.0×10-38,所以c(Fe3+)=![]() =
=![]() =4.0×10-8molL-1,故答案为:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑;4.0×10-8;
=4.0×10-8molL-1,故答案为:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑;4.0×10-8;
(2)A.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,故A错误;B.向水中加Na2CO3固体,促进水的电离,水解呈碱性,故B正确;C.加热至100℃,促进水的电离,溶液呈中性,故C错误;D.向水中加入NH4Cl固体,水解呈酸性,故D错误;故答案为:B;
(3)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,所以最易水解的盐是碳酸钠,所以最容易结合氢离子的阴离子是CO32-;浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大,HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH变化最大的是醋酸,故选C;故答案为:CO32-;C;
(4)A.某温度下纯水中的c(H+)=10-6,氢离子能的和氢氧根离子浓度相同,仍然呈中性,故A错误;B.依据沉淀溶解平衡分析判断,银离子浓度和氯离子浓度乘积为常数,用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小,故B正确;C.相同温度下,铵盐溶液中铵根微弱水解,0.1molL-1NH4Cl溶液中,铵根离子浓度略小于0.1mol/L,氨水是弱电解质存在电离平衡,溶液中NH4+的浓度远远小于0.1mol/L,相同温度下,0.1molL-1NH4Cl溶液中NH4+的浓度比0.1molL-1氨水中NH4+的浓度大,故C正确;D.碳酸根离子水解程度大于碳酸氢根离子,相同温度下,pH均为8的Na2CO3和NaHCO3溶液,后者物质的量浓度大,故D错误;E.向饱和石灰水中加入CaO固体,氧化钙和水反应生成氢氧化钙,析出氢氧化钙,溶液中Ca2+、OH-的物质的量均减小,故E正确;故答案为:AD;
(5)400mL 1molL-1的NaOH的物质的量=1mol/L×0.4L=0.4mol,标准状况下4.48LCO2的物质的量=![]() =0.2mol,所以氢氧化钠和二氧化碳反应方程式为CO2+2NaOH=Na2CO3 +H2O,溶液中碳酸根离子水解而使溶液呈碱性,即c(OH-)>c(H+),碳酸根离子水解生成碳酸氢根离子,且水解程度较小,所以c(CO32-)>c(HCO3-),c(CO32-)>c(OH-),水电离出部分氢氧根质量,故c(OH-)>c(HCO3-),因此溶液中各离子浓度大小顺序是c(Na+) > c(CO32-) > c(OH-) > c(HCO3-) > c(H+),故答案为:c(Na+) > c(CO32-) > c(OH-) > c(HCO3-) > c(H+)。
=0.2mol,所以氢氧化钠和二氧化碳反应方程式为CO2+2NaOH=Na2CO3 +H2O,溶液中碳酸根离子水解而使溶液呈碱性,即c(OH-)>c(H+),碳酸根离子水解生成碳酸氢根离子,且水解程度较小,所以c(CO32-)>c(HCO3-),c(CO32-)>c(OH-),水电离出部分氢氧根质量,故c(OH-)>c(HCO3-),因此溶液中各离子浓度大小顺序是c(Na+) > c(CO32-) > c(OH-) > c(HCO3-) > c(H+),故答案为:c(Na+) > c(CO32-) > c(OH-) > c(HCO3-) > c(H+)。


科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A. 3517Cl2与3717Cl2氧化能力相近,二者互为同位素
B. 过氧化氢的电子式:![]()
C. 同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱
D. 同周期主族元素原子半径随核电荷数的增大而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出下列仪器的名称:
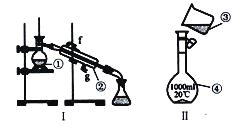
①__________________;②__________________;④__________________;
(2)仪器①~④中,使用时必须检査是否漏水的有_______________(填序号〉
(3)现需配制250 mL0.2mol/LNaCl溶液,装置II是某同学转移溶液的示意图,图中两处错误是_____________,___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业上常用下列方法制备H2:
方法①:C(s)+2H2O(g)![]() CO2(g)+2H2(g)
CO2(g)+2H2(g)
方法②:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJmol-1
②2C(石墨)+O2(g)═2CO2(g)△H=-222kJmol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJmol-1
试计算25℃时由方法②制备1000gH2所放出的能量为_________kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:
C(s)+2H2O(g)![]() CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:

①T1_________T2(填“>”、“=”或“<”);
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是____________。
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_________。
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:

在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是_____________,从t1到t8哪个时间段H2O(g)的平衡转化率最低____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A.由2H和18O所组成的水22g,其中所含的中子数为12 NA
B.分子数为NA的N2、CO混合气体体积在标况下为22.4 L,质量为28 g
C.标准状况下,22.4LNO和11.2L O2混合后气体的分子总数为NA
D.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程不用熵判据判断的是
A.氯化铵与结晶氢氧化钡混合研磨,很快会闻到刺激性气味
B.冬天一杯热水很快变冷
C.有序排列的火柴散落时成为无序排列
D.多次洗牌以后,扑克牌毫无规律的混乱排列的几率大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )

A.转移0.1mol电子时,a电极产生1.12LH2。
B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C.c电极上发生还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SF6是一种优良的绝缘气体,分子结构中存在S—F键。已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热ΔH为
A. -1220 kJ/mol B. -1780 kJ/mol C. -450 kJ/mol D. +430 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com