
【题目】合成氨工业上常用下列方法制备H2:
方法①:C(s)+2H2O(g)![]() CO2(g)+2H2(g)
CO2(g)+2H2(g)
方法②:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJmol-1
②2C(石墨)+O2(g)═2CO2(g)△H=-222kJmol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJmol-1
试计算25℃时由方法②制备1000gH2所放出的能量为_________kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:
C(s)+2H2O(g)![]() CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:

①T1_________T2(填“>”、“=”或“<”);
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是____________。
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_________。
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:

在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是_____________,从t1到t8哪个时间段H2O(g)的平衡转化率最低____________。
【答案】
(1)20500;
(2)①>;②<1.4mol/L;③BD;④增加反应物的浓度;t7-t8。
【解析】
试题分析:(1)CO(g)+H2O(g)CO2(g)+H2(g)的,△H=△H1-△H2-△H3=-394kJmol-1-(-111kJmol-1) -(-242kJmol-1) =-41kJmol-1,所以制备1000g H2所放出的能量为20500kJ,故答案为:20500;
(2)①如果两者温度相等,甲相对乙,甲平衡时H2(g)平衡量为2.4mol,而是3.2,说明温度改变平衡正向移动,而正反应为吸热反应,所以T1>T2;故答案为:>;
②3min内水蒸气的浓度变化量=氢气的浓度变化量的=![]() =1.2mol/L,随反应进行,物质的浓度降低,反应速率变小,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量,故反应进行到1.5min时,H2O(g)的物质的量浓度小于2mol/L-1.2mol/L×
=1.2mol/L,随反应进行,物质的浓度降低,反应速率变小,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量,故反应进行到1.5min时,H2O(g)的物质的量浓度小于2mol/L-1.2mol/L×![]() =1.4mol/L,故答案为:<1.4mol/L;
=1.4mol/L,故答案为:<1.4mol/L;
③A.V逆(CO2)=![]() V逆(H2)=2V正(H2),正逆速度不等,故不选;B混合气体的密度保持不变,说明气体质量不变,正逆速度相等,故选;C.c(H2O):c(CO2):c(H2)=2:1:2,而不是不变,故不选;D.混合气体的平均相对分子质量未平衡时在变,现在保持不变,说明已达平衡状态,故选;故选BD;
V逆(H2)=2V正(H2),正逆速度不等,故不选;B混合气体的密度保持不变,说明气体质量不变,正逆速度相等,故选;C.c(H2O):c(CO2):c(H2)=2:1:2,而不是不变,故不选;D.混合气体的平均相对分子质量未平衡时在变,现在保持不变,说明已达平衡状态,故选;故选BD;
④t1到t6平衡都逆向移动,而t6时平衡正向移动,是因为增加反应物的浓度,而C是固体,所以是增加水蒸气的量,所以本身的转化率降低,t8时反应速率增大,但平衡不移动,故平衡转化率最低t7-t8 (或“t7到t8”),t4时刻速率都比原来速率小,平衡逆向,所以是降低温度,故答案为:增加反应物的浓度;t7-t8。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是:
A. 甲烷的标准燃烧热为890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ/mol
B. CO(g)的燃烧热是283.0 kJ/mol ,则2CO2(g)=2CO(g)+O2(g)的反应热△H="+2×283.0" kJ/mol
C. NaOH和HCl反应的中和热 △H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
D. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
m | n | ||
x | y |
回答下列问题:
(1)元素x在周期表中的位置是 ,其单质可采用电解熔融 的方法制备。
(2)气体分子(mn)2的电子式为 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为 。
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]=Na++[Au(CN)2]-,然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极: ,负极: 。
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色。写出解毒原理的相关离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向正反应方向移动,溶液中c(H+)增大
B.加水,平衡向正反应方向移动,c(CH3COO-)和c(H+)增大
C.加入少量HCl,平衡逆向移动,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向逆反应方向移动,溶液导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将2mol气体A与1mol气体B充入一个体积不变的容器内,发生反应:2A+B![]() C+3D+4E,达到平衡后气体A的浓度减少一半,发现少量液滴生成,在相同的温度下测得反应前后压强分别为6.06×106Pa和8.08×106Pa,又测得反应共放出热量QkJ,下列说法正确的是( )
C+3D+4E,达到平衡后气体A的浓度减少一半,发现少量液滴生成,在相同的温度下测得反应前后压强分别为6.06×106Pa和8.08×106Pa,又测得反应共放出热量QkJ,下列说法正确的是( )
A.上述反应达到平衡后,其他的条件不变的情况下,只改变压强,平衡不移动
B.该反应的化学平衡常数为
C.E为气体
D.该反应的热化学方程式2A(g)+B(g)![]() C(g)+3D(l)+4E(g) △H=-QkJ/mol
C(g)+3D(l)+4E(g) △H=-QkJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温下,Ksp[Fe(OH)3]=4.0×10-38,在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:__________;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为__________molL-1
(2)已知水存在如下平衡:H2OH++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是__________.
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 molL-1]
D.向水中加入NH4Cl固体
(3)常温下,浓度均为0.1molL-1的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是__________,根据表中数据,浓度均为0.01molL-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是__________(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(4)下列说法不正确的是(填序号〕____________。
A.某温度下纯水中的c(H+)=10-6,故其显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.相同温度下,0.1mol/LNH4Cl溶液中NH4+的浓度比0.1mol/L氨水中NH4+的浓度大
D.相同温度下pH均为8 的Na2CO3和NaHCO3溶液,前者物质的量浓度大
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小
(5)实验室中常用NaOH来进行洗气和提纯.当400mL 1molL-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
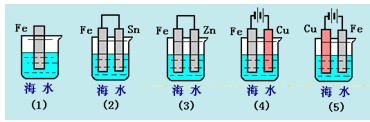
A.(5)(2)(1)(3)(4) B.(2)(5)(3)(4)(1)
C.(5)(3)(4)(1)(2) D.(1)(5)(3)(4)(2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 某溶液![]() 生成白色沉淀,说明原溶液中有Cl-
生成白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 生成白色沉淀,说明原溶液中有SO42-
生成白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
D. 某溶液![]() 生成蓝色沉淀,说明原溶液中有Cu2+
生成蓝色沉淀,说明原溶液中有Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com