
【题目】下列关于化合物,单质,混合物,电解质和非电解质的正确组合是( )
化合物 | 单质 | 混合物 | 电解质 | 非电解质 | |
A | 烧碱 | 液态氧 | 冰水混合物 | 醋酸 | 三氧化硫 |
B | 生石灰 | 白磷 | 胆矾 | 氧化铝 | 氯气 |
C | 干冰 | 铁 | 氨水 | 石灰石 | 酒精 |
D | 空气 | 氮气 | 小苏打 | 氯化铜 | 硫酸钡 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】实验室中常用氧化浓盐酸的方法制取氯气,实验装置如图所示:
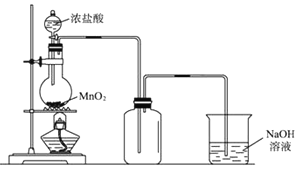
(1)写出制备氯气的离子方程式: ______ ;
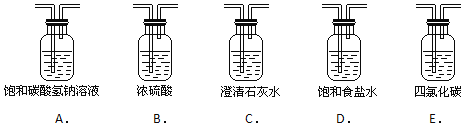
(2)为了得到纯净、干燥的氯气,此装置还需增加净化装置,请根据气体的流动方向,依次按顺序选择所用的装置,正确的选项是 ______ ;
(3)如果将过量二氧化锰与20mL12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,其主要原因有:① ______ ;② ______ .
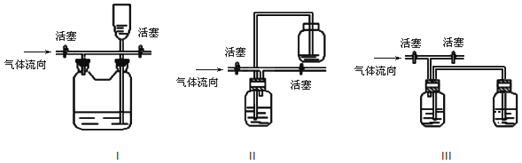
(4)多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。p、q、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质。上述物质的转化关系如下图所示。下列说法错误的是

A. 原子半径:Z>Y>X
B. 最简单气态氢化物的稳定性:Y>X
C. m、n、r都含有离子键和共价键
D. m、n、t都能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应。在标准状况下生成11.2LH2;D原子最外层电子数等于其周期序数;E-的电子层结构与Ar原子相同。
(1)D原子结构示意图为______________,B和C形成的化合物电子式为______________。
(2)B和D简单离子的半径大小为______________。(用离子符号和“>”、“=”或“<”表示)
(3)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是________ (填序号)。
①比较两种单质的颜色 ②比较氢化物的稳定性 ③依据两元素在周期表的位置
④比较原子半径大小 ⑤比较最高价氧化物对应水合物的酸性
(4)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5。则该物质的结构式为__________________________。
(5)关于单质C与冷水反应,下列说法正确的是______________。
①单质C熔化成闪亮的小球,说明该反应是放热反应
②生成H2中含有水蒸汽,液态水变成气态水是吸热反应
③该反应是氧化还原反应,所有氧化还原反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白液、漂白粉和漂粉精既可作棉、麻、纸张的漂白剂,又可用作游泳池及环境的消毒剂.它们在生产、生活中有广泛应用.某实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液,其中有效成分为NaClO)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
(1)小组成员甲同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO﹣具有氧化性.进行如下实验: Ⅰ.取10mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,观察到有白色沉淀生成,经检验白色沉淀不溶于盐酸.
Ⅱ.另取10mL漂白液,加入品红溶液,发现溶液红色逐渐变浅,一段时间后褪为无色.
Ⅲ.再取10mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,观察溶液红色立即变为无色.
①由实验Ⅰ得出ClO﹣具有氧化性,写出相关反应的离子方程式 .
②对比实验Ⅱ和Ⅲ说明ClO﹣氧化性与溶液酸碱性的关系是 .
(2)小组成员乙同学依据(1)中的实验提出:漂白液在酸性溶液中有Cl2生成,为此进行如下实验: 首先,他利用pH计分别测得漂白液pH>7,饱和KAl(SO4)2溶液pH<7.然后用下图1所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2 . 
①在测定漂白液pH的实验中,乙同学没有选择pH试纸的理由可能是;
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生.A中反应的离子方程式 .
③若打开分液漏斗活塞向烧瓶中加入饱和KAl(SO4)2溶液,预计只有观察到以下现象 , 才能说明漂白液与酸性溶液混合会产生Cl2 .
(3)为了进一步了解漂白液生产和保存的实际意义,小组其他成员还研究漂白液的稳定性,他们查阅资料,下图是30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化图2: 
①分析分解速率v(Ⅰ)与v(Ⅱ)的大小关系,原因是
②4d~8d,Ⅰ中v(NaClO)=mol/(Ld)(常温下漂白液的密度约为1g/cm3 , 且溶液体积变化忽略不计,结果保留2位有效数字.)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN﹣N吸收167kJ热量,生成1molN≡N放出942kJ.根据以上信息和数据,下列说法正确的是( ) 
A.N4属于一种新型的化合物
B.N4与N2互为同素异形体
C.N4沸点比P4 (白磷)高
D.1mo1N4气体转变为N2将吸收882kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周环反应是一类同时成键与断键的反应,经典的周环反应有Diels-Alder反应![]() 、电环化反应(electrocyclicreaction):
、电环化反应(electrocyclicreaction): ![]() 等。
等。
已知:  ,其中R1、R2、R3为烷基。
,其中R1、R2、R3为烷基。
现有一种内酯I(含两个五元环)的合成路线如下(A~I均表示一种有机化合物):

回答下列问题:
(1)化合物A中含有的官能团名称是_______,D的分子式为_______。
(2)由C生成D的反应类型为_______,A形成高聚物的结构简式为_______。
(3)写出F与足量银氨溶液反应的化学方程式_______ 。
(4)化合物H的系统命名为_______ 。
(5)化合物I的质谱表明其相对分子质量为142,I的核磁共振氢谱显示为2组峰,I的结构简式为_______ 。
(6)在化合物I的同分异构体中能同时符合下列条件的是_______ (填写结构简式)。
①具有酚结构;②仅有一种官能团;③具有4种氢原子
(7)2,5-二甲基四氢呋喃(![]() )是新的液态代用燃料,其具有比能量高、沸点高、可再生等优点。该有机物可由A先与H2发生加成反应等一系列步骤来制备,请写出合成路线______(其它试剂任选)。
)是新的液态代用燃料,其具有比能量高、沸点高、可再生等优点。该有机物可由A先与H2发生加成反应等一系列步骤来制备,请写出合成路线______(其它试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与生产生活关系密切。请完成下列填空:
(1)肼由N、H 两种元素组成,它常用作火箭推进剂。肼的相对分子质量为32,分子中N、H原子的个数比为1∶2,肼的分子式为_____________。16g 肼分子中所含的氮原子数与标准状况下_______L N2中所含的氮原子数相等。
(2)实验室常用下图所示装置制取并收集氨气。

①实验室制取氨气反应的化学方程式为____________________________________;
②图中方框内收集氨气的装置可选用_________________(填字母序号);
③尾气处理装置中使用倒扣漏斗的作用是_________________________________。
(3)在盛有一定量浓硝酸的试管中加入6.4g的铜片发生反应。请回答下列问题:
①开始阶段,反应的化学方程式为____________________________________,若该反应共产生标准状况下气体2.24L,则反应过程中被还原的HNO3的物质的量为_______。
②反应结束后铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为制备消毒液(主要成分是NaClO),设计了下列装置,并查阅到下列资料:在加热情况下氯气和碱溶液能发生如下反应:3Cl2+6OH﹣ ![]() 5Cl﹣+ClO3﹣+3H2O,请回答下列问题:
5Cl﹣+ClO3﹣+3H2O,请回答下列问题: 
(1)连接好装置,装药品之前,必须进行的一项操作步骤是 .
(2)圆底烧瓶内发生反应的化学方程式为;大试管内发生反应的离子方程式为 .
(3)饱和食盐水的作用是;冰水的作用是 .
(4)在制取Cl2时,实验室中若无MnO2 , 可用KMnO4粉末代替,发生下列反应:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O,则可选择的发生装置是(填序号) .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com