
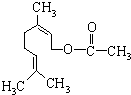
 乙酸橙花酯是一种食用香料,结构如图.关于该物质的说法中正确的是( )
乙酸橙花酯是一种食用香料,结构如图.关于该物质的说法中正确的是( )| A. | ①②④ | B. | ③ | C. | ③⑤ | D. | ②③⑤ |
分析 有机物中含有碳碳双键,可发生加成、加聚和氧化反应,含有酯基,可发生水解反应,结合有机物的组成解答该题.
解答 解:①由结构简式可知分子中含有12个C原子,20个H原子,2个O原子,则分子式为C12H20O2,故错误;
②能与氢氧化钠反应的官能团只有酯基,水解生成羧基和羟基,只有羧基能与氢氧化钠反应,则1mol该有机物水解时只能消耗1mol NaOH,故错误;
③分子中含有2个碳碳双键,则1mol该有机物可消耗2mol H2,酯基与氢气不发生加成反应,故正确;
④含有碳碳双键,可法加成、氧化反应,含有酯基,可发生取代反应,不能发生酯化反应,故错误;
⑤分子中含有3个双键,则不饱和度为3,而酚类物质的不饱和度为4,则它的同分异构体中不可能属于芳香族化合物,故错误.
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质,为解答该题的关键,难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
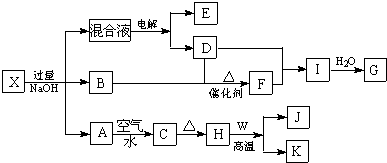
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL lmol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2S04溶液所含硫酸根离子的浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2 g NaHS04晶体中阳离子和阴离子的总数为O.03NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑧ | C. | ③⑤ | D. | ⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
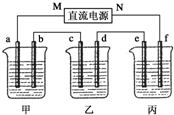 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H2 | C. | C3H8 | D. | C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀pH | 1,9 | 7.0 | 6,7 |
| 沉淀完全pH | $\frac{3}{4}$ | 9.0 | 10.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com