
| A. | 500 mL lmol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2S04溶液所含硫酸根离子的浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2 g NaHS04晶体中阳离子和阴离子的总数为O.03NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
分析 A.溶液中所含的硫酸根离子的浓度与所取溶液的体积无关;
B.从酸性角度比较非金属性强弱,应为最高价氧化物对应的水化物的酸性;
C.NaHS04晶体中存在钠离子和硫酸氢根离子;
D.0.5mol氧化钠溶于1L水中,溶液的体积未知,不能计算浓度.
解答 解:A.500mL 1mol/L Fe2(SO4)3溶液中硫酸根的浓度为3mol/L,250mL 3mol/L 的Na2SO4溶液中硫酸根的浓度为3mol/L,故浓度相同,故A正确;
B.如不是最高价氧化物对应的水化物,则不能根据酸性强弱比较非金属性强弱,故B错误;
C.1.2g NaHS04晶体的物质的量是0.01mol,NaHS04晶体中存在钠离子和硫酸氢根离子,阳离子和阴离子的总数为0.02NA,故C错误;
D.含NA个Na+的Na2O,物质的量为0.5mol,溶解于1L水中,溶液的体积无法计算,不能知道氢氧化钠的物质的量浓度,故D错误;
故选A.
点评 本题考查了微粒浓度、物质结构、非金属性比较等知识点,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确物质结构和非金属性比较方法是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢中既含有极性键又含有非极性键 | |
| B. | 18O原子中含有18个中子 | |
| C. | 含有相同电子数的H2O和NH3的分子数相同 | |
| D. | 苯分子中所有原子共处在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- | |
| B. | NaHCO3溶液中:c(H+)+c(H2CO3)═c(OH-) | |
| C. | 10 mL0.10 mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、OH-、Cl- | B. | Ba2+、H+、SO42-、CO32- | ||
| C. | K+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4具有强氧化性是因为其中含+6价S,所有只要含最高价+6价S的化合物就具有强氧化性 | |
| B. | H2S中的S处于最低价,因此其不可能具有氧化性 | |
| C. | 浓H2SO4可把Na2SO3氧化 | |
| D. | 因为元素化合价变化以相邻价态之间转化最容易,因此发生氧化还原反应时,浓H2SO4对应的产物一般为SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
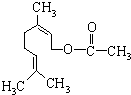 乙酸橙花酯是一种食用香料,结构如图.关于该物质的说法中正确的是( )
乙酸橙花酯是一种食用香料,结构如图.关于该物质的说法中正确的是( )| A. | ①②④ | B. | ③ | C. | ③⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化还原反应在生产、生活中具有广泛的用途.请回答下列问题:
氧化还原反应在生产、生活中具有广泛的用途.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com