
分析 (1)依据氢硫酸溶液中存在得到了平衡分析存在的离子;
(2)溶液稀释10倍,促进电离平衡正向进行;
(3)硫化氢和硫酸铜溶液反应生成硫化铜沉淀和硫酸,氢离子物质的量不变,溶液体积变化为2L,据此计算氢离子浓度得到溶液PH;
(4)第①步HS-的平衡浓度为第②步HS-的起始浓度,设第①步HS-的平衡浓度为x mol/L,S2-的平衡浓度为y mol.L,结合电离平衡和元素守恒列式计算.
解答 解:(1)①H2S(aq)?H+(aq)+HS-(aq); ②HS-(aq)?H+(aq)+S2-(aq),氢硫酸溶液中存在的离子有H+、HS-、S2-、OH-,
故答案为:H+、HS-、S2-、OH-;
(2)某温度下,0.1mol/L的氢硫酸溶液中存在平衡,将该溶液稀释10倍,溶液中的c(H+)<0.01mol/L,
故答案为:<;
(3)向1L该溶液中滴加足量的硫酸铜溶液,有黑色沉淀生成,反应的离子方程式为:H2S+Cu2+═CuS↓+2H+,溶液的酸性增强,1L0.1mol/L的氢硫酸溶液中H2S物质的量为0.1mol,反应后生成氢离子物质的量0.2mol,溶液体积变化为2L,则c(H+)=$\frac{0.2mol}{2L}$=0.1mol/L,溶液PH=1,
故答案为:增强,H2S+Cu2+═CuS↓+2H+,1;
(4)第①步HS-的平衡浓度为第②步HS-的起始浓度,设第①步HS-的平衡浓度为x mol/L,S2-的平衡浓度为y mol.L,则有:
①H2S(aq)?H+(aq)+HS-(aq);
x x
②HS-(aq)?H+(aq)+S2-(aq);
c0=x 0 0
c平=x-y y y
x-y=b
x+y=a
c(S2-)=y=$\frac{a-b}{2}$,
故答案为:$\frac{a-b}{2}$.
点评 本题考查了弱电解质电离平衡的影响因素、电离平衡的计算分析、注意硫化铜不溶于酸,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Cl-)=c(NH4+) | B. | NH4+水解程度增大 | ||
| C. | 氨水电离程度增大 | D. | 溶液中有少量NH4Cl存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
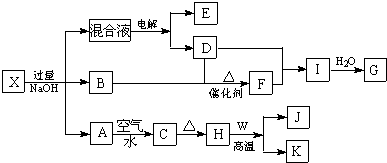
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
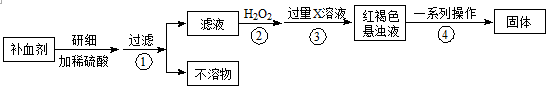
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
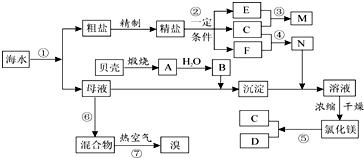

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
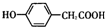 ;写出A与NaHCO3溶液反应的化学方程式
;写出A与NaHCO3溶液反应的化学方程式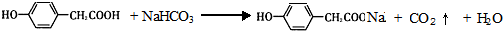 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL lmol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2S04溶液所含硫酸根离子的浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2 g NaHS04晶体中阳离子和阴离子的总数为O.03NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com