
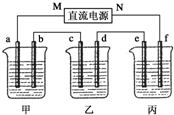
 5.00%��NaOH��Һ��������CuSO4��Һ��100g 10.00%��K2SO4��Һ���缫��Ϊʯī�缫��
5.00%��NaOH��Һ��������CuSO4��Һ��100g 10.00%��K2SO4��Һ���缫��Ϊʯī�缫������ ��1��������C�缫�������ӣ���c�������ķ�ӦΪ��Cu2++2e-=Cu����C��Ϊ�������ɴ˿��Ƴ�bΪ������aΪ������MΪ������NΪ����������ΪK2SO4���൱�ڵ��ˮ�������ˮ������Ϊx���ɵ��ǰ��������������У�100��10%=��100-x����10.47%����x=4.5g����Ϊ0.25mol���ɷ���ʽ2H2+O2�T2H2O��֪������2molH2O��ת��4mol���ӣ�����������Ӧ��ת��0.5mol���ӣ���������·�Ǵ����ģ���ÿ���ձ��еĵ缫��ת�Ƶ���������ȵģ�
�ڼ���ΪNaOH���൱�ڵ��H2O������b��Ϊ������OH-�ŵ磬��4OH--4e-=2H2O+O2����
��ת��0.5mol���ӣ�������O2Ϊ$\frac{0.5}{4}$=0.125mol������µ����Ϊ0.125��22.4=2.8L��
��Cu2++2e-=Cu��ת��0.5mol���ӣ������ɵ�m��Cu��=$\frac{0.5}{2}$��64=16g��
�ݼ����൱�ڵ��ˮ����NaOH��Ũ������pH�����������ΪCu2+�ŵ磬����ΪOH-�ŵ磬����H+���࣬��pH��С������Ϊ���ˮ������K2SO4���ԣ���pH�������䣮
��2��ͭȫ�����������Լ������H2SO4���е��Һ���ɵ�⣮
��� �⣺��1�����ұ���c�������ӣ�˵��Cu������c�缫�ϣ������Ǵ�b-c�ƶ���M�Ǹ�����NΪ�������ʴ�Ϊ��������
�ڼ���ΪNaOH���൱�ڵ��H2O������b��Ϊ������OH-�ŵ磬��4OH--4e-=2H2O+O2�����ʴ�Ϊ��4OH--4e-=2H2O+O2����
�۱���ΪK2SO4���൱�ڵ��ˮ�������ˮ������Ϊx���ɵ��ǰ��������������У�100��10%=��100-x����10.47%����x=4.5g����Ϊ0.25mol���ɷ���ʽ2H2+O2�T2H2O��֪������2molH2O��ת��4mol���ӣ�����������Ӧ��ת��0.5mol���ӣ�������O2Ϊ$\frac{0.5}{4}$=0.125mol������µ����Ϊ0.125��22.4=2.8L���ʴ�Ϊ��2.8L��
��������·�Ǵ����ģ�����ÿ���ձ��еĵ缫��ת�Ƶ���������ȵģ����ݵ缫��Ӧ��Cu2++2e-=Cu����֪ת��0.5mol�������ɵ�m��Cu��=$\frac{0.5}{2}$��64=16g���ʴ�Ϊ��16��
�ݼ����൱�ڵ��ˮ����NaOH��Ũ������pH�����������ΪCu2+�ŵ磬����ΪOH-�ŵ磬��ⷽ��ʽΪ��2CuSO4+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2Cu+O2��+2H2SO4������H+���࣬��pH��С������Ϊ���ˮ������K2SO4���ԣ���pH�������䣮
�ʴ�Ϊ����������Ϊ�൱�ڵ��ˮ���Ҽ�С��OH-�ŵ磬H+���ࣻ�����䣬�൱�ڵ��ˮ��
��2����ͭȫ������ʱ����Һ�����е�������ᣬ���Լ�����⣬�𣺿��ԣ� ͭȫ�����������Լ������H2SO4���е��Һ���ɵ�⣮
���� ����Ϊ�绯ѧ֪ʶ���ۺ�Ӧ�ã�����ʱҪע����ݵ缫��Ӧ�����жϳ����ص��������������жϳ���Դ����������Ҫע����������Ϊ������·�����缫�ϵ�ʧ���ӵ���Ŀ��ȣ�����ʱҪ��ȷд���缫����ʽ��ȷ�ж����������ӵķŵ�˳��


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ŨH2SO4����ǿ����������Ϊ���к�+6��S������ֻҪ�����+6��S�Ļ�����;���ǿ������ | |
| B�� | H2S�е�S������ͼۣ�����䲻���ܾ��������� | |
| C�� | ŨH2SO4�ɰ�Na2SO3���� | |
| D�� | ��ΪԪ�ػ��ϼ۱仯�����ڼ�̬֮��ת�������ף���˷���������ԭ��Ӧʱ��ŨH2SO4��Ӧ�IJ���һ��ΪSO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������������AgI�����FeCl3��Һ | |
| B�� | ����Ƭ�̺�Fe��OH��3�����л���ֲַ����� | |
| C�� | ��Һ�����塢��Һ�ĸ��������Ƿ�ɢ������ֱ���Ĵ�С | |
| D�� | �������Ҫ�����У����������Ӿ���۳��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
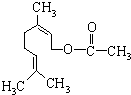 ����Ȼ�����һ��ʳ�����ϣ��ṹ��ͼ�����ڸ����ʵ�˵������ȷ���ǣ�������
����Ȼ�����һ��ʳ�����ϣ��ṹ��ͼ�����ڸ����ʵ�˵������ȷ���ǣ�������| A�� | �٢ڢ� | B�� | �� | C�� | �ۢ� | D�� | �ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ca��HCO3��2$\frac{\underline{\;\;��\;\;}}{\;}$CaCO3��+H2O+CO2�� | B�� | MgCO3+CO2+H2O�TMg��HCO3��2 | ||
| C�� | MgCO3+H2O$\frac{\underline{\;\;��\;\;}}{\;}$Mg��OH��2��+CO2�� | D�� | CaCO3+H2O�TCa��OH��2+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 0��lmol•L-lNaHC2O4��Һ��pH=5.5����c��Na+����c�� HC2O4-����c��H2C2O4����c��C2O42- �� | |
| B�� | 0��lmol•L-1NaHS ��Һ��C��OH-��+c��S2-��=c�� H+��+c��H2S�� | |
| C�� | 0��lmol•L-1CH3COOH ��Һ�� 0��lmol•L-1CH3COONa ��Һ�������ϣ�c��Na+����c��CH3COOH����c��CH3COO-����c��H+����c�� OH-�� | |
| D�� | 0��lmol•L-lNH4HSO4 ��Һ�еμ� 0��lmol•L-1NaOH ��Һ�����ԣ�c��Na+ ����c��SO42- ����c��NH4+ ����c��OH-��=c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Һ | B�� | ��ˮ | C�� | ��������Һ | D�� | �Ȼ�����Һ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com