
【题目】下列变化,需要加入适当的氧化剂才能完成的是( )
A.SO2→SO32ˉB.PCl3→PCl5C.MnO4ˉ→Mn2+D.Cl2→HClO
科目:高中化学 来源: 题型:
【题目】如图为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是

A. 分子中含有三种含氧官能团
B. 1mol该化合物最多能与4molNaOH反应
C. 既可以发生取代反应,又能够发生加成反应
D. 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,他们性质如下:
A | 周期表中原子半径最小的元素 |
B | 电负性最大的元素 |
C | C的2p轨道中有三个未成对的单电子 |
D | 原子核外电子数是B与C核外电子数之和 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答如下问题:
(1)基态E原子有_____个未成对电子,二价E离子的核外电子排布式为_______。
(2)A2D分子中D原子的杂化类型是______,D的氧化物DO3分子空间构型为_______。
(3)CA3极易溶于水,其原因主要是_____,试判断CA3溶于水后,形成CA3· H2O的合理结构:____ (填字母代号), 推理依据是_____。

(4)在ESO4溶液中滴入过量氨水,形成配合物的颜色为______,反应的离子方程式为_____。
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为______。
(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为______(用含a、NA的代数式表示)g· cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.Al2O3熔点高,可用作耐高温材料
B.FeCl3溶液呈酸性,可用于腐蚀Cu
C.铝导热性好,可用铝罐贮运浓硝酸
D.浓硫酸具有强氧化性,可用于干燥CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,可按溶解、过滤、蒸发结晶的操作顺序分离的是( )
A.CaO和KCl
B.CuO和NaCl
C.BaSO4和CaCO3
D.NaCl和AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,用0.10mol·L-1的盐酸分别滴定体积相同且浓度均为0.10mol·L-1的三种一元碱XOH、YOH及ZOH,滴定曲线如图所示。
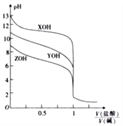
下列说法正确的是( )
A. YOH是强碱 B. 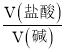 =0.5时,c(Z+)>c(Y+)>c(X+)
=0.5时,c(Z+)>c(Y+)>c(X+)
C. X++H2O![]() XOH+H+的平衡常数K=10-4 D. 滴定XOH时可用酚酞作指示剂
XOH+H+的平衡常数K=10-4 D. 滴定XOH时可用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN(氰化钠)是一种重要的基础化工原料,可用于电镀、冶金和有机合成等。回答下列问题。
(1)NaCN溶液中发生水解反应的离子方程式为_______________________________,实验室配制NaCN溶液的方法是______________________________。
(2)NaCN与Cl2反应可制备ClCN(氯氰),氯氰的电子式为_________。
(3)制备NaCN的方法很多种。
①氨钠法:反应原理为2Na+2C+2NH3![]() 2NaCN+3H2。该反应中,每生成1molNaCN,转移电子的物质的量为_________。
2NaCN+3H2。该反应中,每生成1molNaCN,转移电子的物质的量为_________。
②NaCN也可由HCN 与NaOH反应制得。
已知:CH4(g)=C(s)+2H2(g) △H1;
2HCN(g)=2C(s)+H2(g)+N2(g) △H2;
N2(g)+3H2(g)![]() 2NH3(g) △H3。
2NH3(g) △H3。
则反应:CH4(g)+NH3(g)![]() HCN(g)+3H2(g)的△H=____________(用含△H1、△H2、△H3的代数式表示)。
HCN(g)+3H2(g)的△H=____________(用含△H1、△H2、△H3的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极c、d表面镀一层细小的铂粉,吸附气体的能力强,性质稳定,请回答:
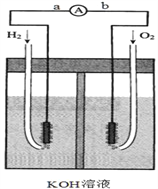
(1)氢氧燃料电池的能量转化主要形式是______。
(2)负极反应式为______.
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H2 = 2LiH II. LiH +H2O = LiOH + H2↑
①反应I中的还原剂是______,反应II中的氧化剂是______
②已知LiH固体密度为0.82g/cm3,用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为______。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与进步作出了巨大贡献。
(1)450℃时,在一个体积为2L的恒容密闭容器中充入0.4 mol N2和0.6 mol H2(10min时改变某一条件),测得反应过程中N2、H2和NH3的物质的量随时间变化如下表:
时间 物质的量 | 5 min | 10 min | 15 min | 20 min | 25 min |
n(N2)/mol | 0.36 | 0.35 | 0.275 | 0.25 | 0.25 |
n(H2)/mol | 0.48 | 0.45 | 0.225 | 0.15 | 0.15 |
n(NH3)/mol | 0.08 | 0.1 | 0.25 | 0.30 | 0.30 |
①5~10 min内,生成NH3的平均反应速率是_______ mol/(L·min)。
②下列能作为判断该反应达到化学平衡状态的依据是_______(填字母序号)。
A.v(N2)正=3v(H2)逆 B.容器内压强保持不变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子量不变
③第10 min时改变的条件是使用了高效催化剂,理由是_______。
(2)合成氨的反应原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH。
2NH3(g) ΔH。
相关化学键键能数据如下:
化学键 | H—H | N≡N | N—H |
E /(kJ/mol) | 436 | 946 | 391 |
由此计算ΔH=_______kJ/mol,低温下,合成氨反应_______(填“能”或“不能”)自发进行。已知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)![]() N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应Ⅰ:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H =﹣906kJ/mol
4NO(g)+6H2O(g) △H =﹣906kJ/mol
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H =﹣1267kJ/mol
2N2(g)+6H2O(g) △H =﹣1267kJ/mol
①该条件下,N2(g)+O2(g)![]() 2NO(g) △H = _______kJ/mol
2NO(g) △H = _______kJ/mol
②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应_______(填“反应Ⅰ”或“反应II”)。520℃时,反应Ⅰ的平衡常数K=_______(只列算式不计算)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com