
【题目】25℃ 时,用0.10mol·L-1的盐酸分别滴定体积相同且浓度均为0.10mol·L-1的三种一元碱XOH、YOH及ZOH,滴定曲线如图所示。
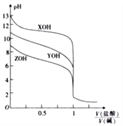
下列说法正确的是( )
A. YOH是强碱 B. 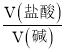 =0.5时,c(Z+)>c(Y+)>c(X+)
=0.5时,c(Z+)>c(Y+)>c(X+)
C. X++H2O![]() XOH+H+的平衡常数K=10-4 D. 滴定XOH时可用酚酞作指示剂
XOH+H+的平衡常数K=10-4 D. 滴定XOH时可用酚酞作指示剂
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。

查阅资料可知:
①2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3。
②NO能被酸性KMnO4氧化成NO3-。
③在酸性条件下,NaNO2能将I-氧化为I2;S2O32-能将I2还原为I-,即I2+2S2O32-=2I-+S4O62-。中反应的化学方程式是
(1)装置中仪器a的名称为______________。A中反应的化学方程式是_______________。
(2)装置B中观察到的主要现象是_____________________。
(3)装置C中盛放的试剂是______________________。
(4)装置E的作用是___________________。
(5)A中滴入浓硝酸之前,应先通入N2一段时间,原因是__________________。
(6)为测定所得NaNO2的纯度,准确称取mgNaNO2样品放入锥形瓶中并加入适量水溶解,再加入过量KI溶液并滴入几滴淀粉溶液,然后滴加稀硫酸,用cmol/LNa2S2O3溶液滴定至终点,重复操作2~3次,平均消耗Na2S2O3V ml。滴定终点的现象是___________________。该样品中NaNO2的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氯化物时,常用两种方法:①用金属与氯气直接化合制得;②用金属与盐酸反应制得.用以上两种方法都可制得的氯化物是( )
A.AlCl3
B.FeCl3
C.FeCl2
D.CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究铝元素、硫元素及其化合物的性质具有重要意义
(1)①NH4A1(SO4)2可作净水剂,用必要的化学用语及文字说明其理由是_________。
②相同条件下,0.1mol NH4A1(SO4)2溶液中的c(NH4+)______(填“大于”“小于”或“等于”)0.1mol·L-1NH4HSO4溶液中的c(NH4+)。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)=_____mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=______。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为_____。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W的原子序教都不超过18,它们的离子aX(n+1)+、bYn+、cZ(n+1)-、dWn-具有相同的电子层结构,则下列说法正确的是( )
A. 离子氧化性:X(n+1)+>Yn+ B. 离子半径:X(n+1)+>Yn+>Z(n+1)->Wn-
C. 原子序数:a>b>c>d D. 原子半径:Z>W>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答:
![]()
(1)写出元素符号:A ____;C ___。
(2)B元素位于元素周期表第____周期第____族;其最高价氧化物对应水化物的化学式为____。
(3)A的氢化物的电子式为 _________; A的氢化物与其最高价氧化物的水化物反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需用480mL0.1mol·L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68g硫酸铜,配成500mL溶液
B.称取12.0g胆矾,加入500mL水
C.称取8.0g硫酸铜,加入500mL水
D.称取12.5g胆矾,配成500mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
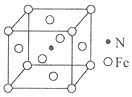
【题目】用还原铁粉制备二茂铁开辟了金属有机化合物研究的新领域。二茂铁甲酰胺是其中一种重要的衍生物,结构如图所示。

(1)基态Fe原子价层电子排布式是_______。
(2)已知二茂铁甲酰胺熔点是176℃,沸点是249℃,难溶于水,易溶于氯仿、丙酮等有机溶剂。据此可推断二茂铁甲酰胺晶体为_______晶体。
(3)二茂铁甲酰胺中碳原子的杂化方式为_________,H、C、N、O四种元素的电负性由大到小的顺序是_________。
(4)碳、氮元素对应的最简单氢化物分别是CH4和NH3,相同条件下CH4的沸点比NH3的沸点_______(填“高”或“低”),主要原因是_______。
(5)氢、氮、氧三种元素按照4:2:3的原子个数比形成离子化合物。该离子化合物中,阳离子空间构型是_______,1 mol阴离子含有σ键的数目为_______。
(6)氮和铁能形成一种磁性材料,其晶胞如图所示,该磁性材料的化学式为_______。已知晶胞参数为a nm,则该晶胞密度的计算式为ρ=_______g/cm3(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com