
【题目】已知X、Y、Z、W的原子序教都不超过18,它们的离子aX(n+1)+、bYn+、cZ(n+1)-、dWn-具有相同的电子层结构,则下列说法正确的是( )
A. 离子氧化性:X(n+1)+>Yn+ B. 离子半径:X(n+1)+>Yn+>Z(n+1)->Wn-
C. 原子序数:a>b>c>d D. 原子半径:Z>W>Y>X
【答案】A
【解析】
它们的离子aX(n+1)+、bYn+、cZ(n+1)-、dWn-具有相同的电子层结构,均具有相同的电子层结构,则有:![]() ,则有X、Y在周期表中Z、W的下一周期,并且原子序数:
,则有X、Y在周期表中Z、W的下一周期,并且原子序数:![]() ,结合元素周期律递变规律解答该题.
,结合元素周期律递变规律解答该题.
A、金属性越强,对应离子的氧化性越弱,离子氧化性:X(n+1)+>Yn+,故A正确;B、具有相同电子层结构的离子,原子序数大的离子半径小,则离子半径为Z(n+1)->Wn->Yn+>X(n+1)+,故B错误;C、它们的离子aX(n+1)+、bYn+、cZ(n+1)-、dWn-具有相同的电子层结构,均具有相同的电子层结构,则有:![]() ,则有X、Y在周期表中Z、W的下一周期,并且原子序数:
,则有X、Y在周期表中Z、W的下一周期,并且原子序数:![]() ,故C错误;D、原子半径:Y>X>Z>W,故D错误,故选A
,故C错误;D、原子半径:Y>X>Z>W,故D错误,故选A


科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
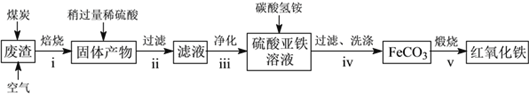
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全,则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:___________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________。
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
![]()
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:
_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存正确的是( )
A.过氧化钠保存在潮湿的环境中B.保存NaOH的试剂瓶用玻璃塞
C.新制氯水保存在棕色瓶中D.金属钠保存在CCl4中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工原料,工业上用N2和H2合成NH3。现己知N2(g)和H2(g)反应生成1 molNH3(g)过程中能量变化示意图如下图。则N-H键键能为( )

化学键 | H-H | N≡N |
键能(kJ/mol) | 436 | 946 |
A. 248kJ/mol B. 391kJ/mol C. 862kJ/mol D. 431kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,用0.10mol·L-1的盐酸分别滴定体积相同且浓度均为0.10mol·L-1的三种一元碱XOH、YOH及ZOH,滴定曲线如图所示。
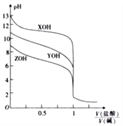
下列说法正确的是( )
A. YOH是强碱 B. 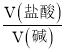 =0.5时,c(Z+)>c(Y+)>c(X+)
=0.5时,c(Z+)>c(Y+)>c(X+)
C. X++H2O![]() XOH+H+的平衡常数K=10-4 D. 滴定XOH时可用酚酞作指示剂
XOH+H+的平衡常数K=10-4 D. 滴定XOH时可用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁的单质及其化合物用途非常广泛。
(1)镁热还原法可制备铷、钛等金属,已知下列物理常数:
Mg | Rb | RbCl | MgCl2 | |
熔点/℃ | 648 | 38.89 | 718 | 714 |
沸点/℃ | 1107 | 688 | 1390 | 1412 |
在750℃时可实现用镁还原RbCl制Rb,该反应能够发生的原因是_________________________________(用文字和化学方程式说明)。
(2)无机抗菌剂Mg2ClO(OH)3·H2O(碱式次氯酸镁)可由MgCl2、NaOH及Cl2反应制得,该反应的化学方程式为______________________________________。
(3)CaC2冶镁的原理为CaC2(s)+MgO(s)![]() CaO(s)+Mg(g)+2C(s) △H,反应达到平衡时Mg的产率随温度的变化如图所示。
CaO(s)+Mg(g)+2C(s) △H,反应达到平衡时Mg的产率随温度的变化如图所示。

①△H__________(填“>"或“<”,下同)0。
②已知A、B中固体总质量相等,则![]() :A__________B。
:A__________B。
(4)Mg(OH)2浆液可脱除烟气中的SO2,其脱硫效率、pH及时间的关系如图所示。

Mg(OH)2浆液脱除SO2的过程中包含的主要反应如下:
Ⅰ.Mg(OH)2+SO2=MgSO3+H2O
Ⅱ.MgSO3+SO2+H2O=Mg(HSO3)2
Ⅲ.Mg(HSO3)2+Mg(OH)2=2MgSO3+2H2O
Ⅳ.2MgSO3+O2=2MgSO4
已知:20℃时,H2SO3的电离平衡常数K1=1.54×10-2、K2=1.02×10-7;25℃时,Ksp[Mg(OH)2]=1.2×10-11,MgSO3,的溶解度为0.646g。
①脱硫过程中使浆液pH减小最显著的反应是__________(填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
②约900s之后,脱硫效率明显降低,其原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化物的叙述正确的是( )
A.非金属氧化物一定是酸性氧化物
B.碱性氧化物一定是金属氧化物
C.碱性氧化物都能与水化合生成碱
D.酸性氧化物都能与水化合生成酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量AgCl分别放入:①5ml 水②10mol0.2mol·L-1MgCl2溶液③20ml0.5mol·L-1NaCl溶液④40ml0.1mol·L-1盐酸中溶解至溶液饱和,各溶液Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是( )
A. a>b>c>d B. d>b>c>a C. a>d>b>c C.c>b>d>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一个2L的密闭容器中发生反应4A(s)+3B(g)2C(g)+D(g),经2min达平衡状态,此时B反应消耗了0.9mol,下列说法正确的是
A. 平衡状态时A、B、C、D的反应速率均为0
B. C的平均反应速率为:0.15mol/(Lmin)
C. 充入N2使压强增大可加快反应速率
D. 此时,V(A):V(B):V(C):V(D)=4:3:2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com