
【题目】已知非金属单质硫(S)是谈黄色固体扮末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验。请回答下列问题:
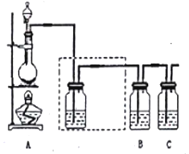
(1)装置A的分液漏斗中盛装的试剂是_______,烧瓶中加入的试剂是_________。
(2)虚线框内的实验装置图中所加试剂为_______,说明装置的作用_________。
(3)装置B中盛放的试剂是_______(选填下列所给试剂的代码)。实验现象为________,化学反应方程式是___________,该反应属于四种基本反应类型中的_______反应。
A. Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。_______。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气。写出该反应的离子方程式_______________。
【答案】 浓盐酸 MnO2 饱和食盐水 除去Cl2中的HCl气体 A 有淡黄色沉淀生成 Na2S+Cl2=2NaCl+S↓ 置换 HCl的稳定性比H2S的稳定性强或HClO4的酸性比H2SO4的酸性强 Cl2+2OH-=Cl-+ClO-+H2O。
【解析】(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO2;(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此虚线框中的装置应是除去HCl气体的装置,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度;(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,化学方程式为Na2S+Cl2=2NaCl+S↓;(4)我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难易程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HClO4的酸性比H2SO4的酸性强;氯气的氧化性强于单质S的氧化性,或是S2-比Cl-易被氧化;还可以根据单质将变价金属氧化到的价态高低来确定单质的氧化性,进而确定元素的非金属性强弱;(5)氯气有毒,可以用氢氧化钠溶液来吸收,尾气处理时的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】铜与浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 混合气体,这些气体与3.36LO2(标况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸,则消耗铜的质量为( )
A.6.4g B.9.6g C.19.2g D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学学习小组设计了两组实验来探究元素周期律。
Ⅰ.甲组同学为验证卤素单质氧化性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
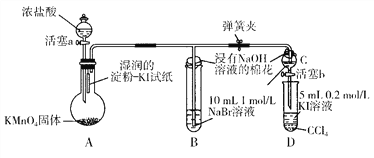
实验过程及现象:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静
置后CCl4层溶液变为紫红色。
请回答下列有关问题:
(1)验证氯气的氧化性强于碘的实验现象是______________________________。
(2)B和C仪器口盛放浸有NaOH溶液的棉花的作用_______________________。
(3)过程Ⅲ实验的目的是_____________________________。
(4)由此实验得出的结论:同主族元素从上到下,原子半径逐渐增大,得电子能力逐渐_____________ (填“减弱”或“增强”)。
Ⅱ.乙组同学设计了如图1装置来一次性完成验证C、Si、S非金属性强弱的实验研究。
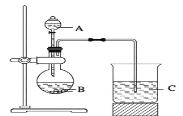
(1)A中所盛溶液的名称是__________。
(2)B仪器的名称是____________。
(3)烧杯C中发生反应的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某温度下的可逆反应N2(g)+3H2(g) ![]() 2NH3(g)。下列事实能说明该反应达到化学平衡状态的是
2NH3(g)。下列事实能说明该反应达到化学平衡状态的是
A. N2、H2的浓度之比保持不变
B. N2和H2的反应速率之比为1:3
C. NH3的生成速率与H2的生成速率之比为2:3
D. 体系中N2、H2、NH3的分子个数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=4×10-10,下列说法不正确的是

A.在t℃时,AgBr的Ksp为4.9×l0-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数数值,下列有关说法正确的是
A. 18.4 mol/L的浓硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 50 mL 14.0 mol·L-1浓硝酸与足量铜反应,转移的电子数为0.35 NA
D. 同温同压同体积下的两种气体12C18O和14N2具有的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:

下列叙述正确的是 ( )
A. X、Y元素的金属性X<Y
B. 一定条件下,Z单质与W的常见单质直接生成ZW2
C. Z 的最高价氧化物对应的水化物能与其氢化物反应
D. Y的最高价氧化物对应的水化物能溶于氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是短周期元素,其部分性质如下表:
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的 |
Z | 第三周期原子半径最小的金属元素 |
下列说法正确的是
A. 气态氢化物的热稳定性:X>W B. Z的氧化物中含有非极性共价键
C. 离子半径:Z>W D. 最高价氧化物对应水化物的酸性:Y>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com