
【题目】常温下,下列有关判断正确的是![]()
A.NaOH溶液与![]() 溶液混合至中性后:
溶液混合至中性后:![]()
B.![]() 的
的![]() 溶液与
溶液与![]() 的KOH溶液等体积混合后:
的KOH溶液等体积混合后:![]()
C.![]() 的
的![]() 溶液与
溶液与![]() 的
的![]() 溶液等体积混合后:
溶液等体积混合后:![]()
D.pH相等的![]()
![]()
![]() 溶液,
溶液,![]() 大小顺序:
大小顺序:![]()
【答案】D
【解析】
A、NaOH溶液与CH3COOH溶液混合至中性后,H+、OH-浓度远远小于CH3COO-、Na+浓度,所以正确的离子浓度关系为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),A错误;
B、常温下,pH=3的CH3COOH溶液中CH3COOH浓度大于10-3mol/L,pH=11的KOH溶液中KOH浓度等于10-3mol/L,两溶液等体积混合时,CH3COOH过量,溶液呈酸性,pH<7,c(H+)>c(OH-),溶液中正确的离子浓度大小为: c(CH3COO-)>c(K+)>c(H+)>c(OH-),B错误;
C、常温下,pH=3的HNO3溶液的浓度为0.01mol/L,而pH=12的NH3·H2O溶液的浓度大于0.01mol/L,两溶液等体积混合后,溶液显示碱性,则c(OH-)>c(H+),溶液中正确的离子浓度大小为:c(NH4+)>c(NO3-)>c(OH-)>c(H+),C错误;
D、pH相等的①NH4Cl溶液②(NH4)2SO4溶液③NH4HSO4溶液,①②都是NH4+水解导致溶液显示酸性,溶液的pH相等,则NH4+浓度相等;③中NH4HSO4完全电离出H+,导致酸性大大增强,pH相等时③的中NH4+浓度最小,所以pH相等时c(NH4+)大小顺序为:①=②>③,D正确;
故选D。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是
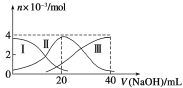
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-) >c(H+) >c(OH-)
B.等浓度的NaOH溶液与H2A溶液按2∶1混合后,其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做浓硫酸性质的实验:
在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有NaOH溶液的棉花。加热试管,观察现象。
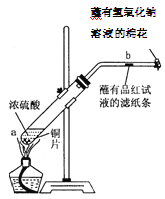
回答下列问题:
(1)写出试管中发生反应的化学方程式____________________。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为_______________,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为_____________。
(3)蘸有NaOH溶液的棉花团作用是________________________________________。
(4)硫酸型酸雨的形成过程可用下列反应中的__________来表示。
A:SO2+H2O![]() H2SO3
H2SO3
B:O2+2H2SO3=2H2SO4
C:SO2+H2O2=H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl)>c(OH)>c(H+)
C. 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO)>c(OH)>c(H+)
D. 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
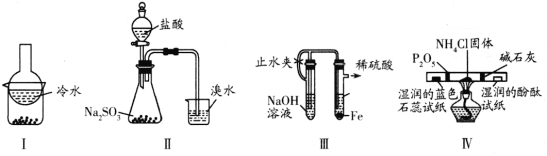
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写错误的是( )
A.乙醇催化氧化制取乙醛:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯:![]() +HNO3
+HNO3![]()
![]()
C.乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
D.乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2Br—CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
![]() 航天领域中常用
航天领域中常用![]() 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。![]() 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱![]() 用电离方程式表示
用电离方程式表示![]() 显碱性的原因是:________________。
显碱性的原因是:________________。
![]() 在恒温条件下,
在恒温条件下,![]() 和足量C发生反应
和足量C发生反应![]() ,测得平衡时
,测得平衡时![]() 和
和![]() 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
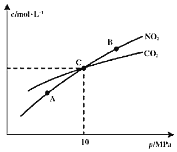
![]() 、B两点的浓度平衡常数关系:
、B两点的浓度平衡常数关系:![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() 、B、C三点中
、B、C三点中![]() 的转化率最高的是______
的转化率最高的是______![]() 填“A”或“B”或“C”
填“A”或“B”或“C”![]() 点。
点。
![]() 计算C点时该反应的压强平衡常数
计算C点时该反应的压强平衡常数![]() ______
______![]() 是用平衡分压代替平衡浓度计算,分压
是用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 已知:亚硝酸
已知:亚硝酸![]() 性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数
性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数![]() ;
;![]() 的
的![]() ,
,![]() 在常温下向含有2mol碳酸钠的溶液中加入1mol的
在常温下向含有2mol碳酸钠的溶液中加入1mol的![]() 后,则溶液中
后,则溶液中![]() 、
、![]() 和
和![]() 的离子浓度由大到小的顺序是______。
的离子浓度由大到小的顺序是______。
![]() 已知:常温下甲胺
已知:常温下甲胺![]() 的电离常数为
的电离常数为![]() ,且
,且![]() 水溶液中有
水溶液中有![]() ,常温下向
,常温下向![]() 溶液滴加稀硫酸至
溶液滴加稀硫酸至![]() 时,则溶液
时,则溶液![]() ______。
______。
![]() 一种煤炭脱硫技术可以把硫元素以
一种煤炭脱硫技术可以把硫元素以![]() 的形成固定下来,但产生的CO又会与
的形成固定下来,但产生的CO又会与![]() 发生化学反应,相关的热化学方程式如下:
发生化学反应,相关的热化学方程式如下:![]()
![]()
![]() ,反应
,反应![]() ______
______![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200KJ/mol,温度不同(T2>T1)其他条件相同时,下列图像正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同,A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A元素单质的化学式为__________,D元素的离子结构示意图为____________。
(2)写出C、D、E最高价氧化物对应水化物的化学式________、_________、__________(用化学式表示)。
(3)由E元素形成的单质的结构式可表示为__________。
(4)由A、B、C三种元素形成的化合物的电子式为_________,这种化合物中所含的化学键类型有________。
(5)H2D、HE、HF的稳定性由强到弱的顺序为_______(用化学式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com