
【题目】一种气态烷烃和气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍,该混合气体通过装有溴水的试剂瓶时,试剂瓶总质量增加8.4g,该混合气体是
A.乙烯和乙烷B.甲烷和乙烯
C.丙烯和甲烷D.丙烯和乙烷
【答案】B
【解析】
混合气体的密度是相同状况下H2密度的12.5倍,所以混合物的平均摩尔质量为12.5×2g/mol=25gmol-1,混合气体的总的物质的量为![]() =0.4mol,该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以烷烃的质量为10g-8.4g=1.6g,若烷烃为甲烷,甲烷的物质的量为
=0.4mol,该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以烷烃的质量为10g-8.4g=1.6g,若烷烃为甲烷,甲烷的物质的量为![]() =0.1mol,故烯烃的物质的量为0.4mol-0.1mol=0.3mol,所以M(烯烃)=
=0.1mol,故烯烃的物质的量为0.4mol-0.1mol=0.3mol,所以M(烯烃)=![]() =28gmol-1,为乙烯;若烷烃为乙烷,乙烷的物质的量为
=28gmol-1,为乙烯;若烷烃为乙烷,乙烷的物质的量为![]() =
=![]() mol,故烯烃的物质的量为0.4mol-
mol,故烯烃的物质的量为0.4mol-![]() mol=
mol=![]() mol,所以M(烯烃)=
mol,所以M(烯烃)=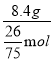 =24.2gmol-1,无符合的烯烃,舍去,所以混合物为甲烷和乙烯,答案选B。
=24.2gmol-1,无符合的烯烃,舍去,所以混合物为甲烷和乙烯,答案选B。


科目:高中化学 来源: 题型:
【题目】实验室制备光敏材料KaFeb(C2O4)c·xH2O的工艺流程如下:
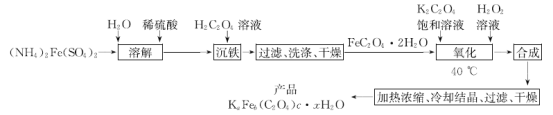
回答下列问题:
(1)“溶解”时,为使所用的水中不含O2,采用的操作方法是_________________。
(2)用H2C2O4(弱酸)“沉铁”时,反应的离子方程式为______________。
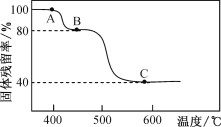
(3)FeC2O4·2H2O热分解与气氛及温度有关,在N2气氛中热分解时,固体的残留率(固体样品的剩余质量/固体样品的起始质量×100%)与温度的关系如图所示,则B→C的变化中,发生反应的化学方程式为___________________。
(4)“氧化”时,温度不宜超过40℃,其原因是_______。
(5)为测定产品KaFeb(C2O4)c·xH2O(铁元素为+3价)的组成,称取产品0.2455g用硫酸溶解后,用0.02000 mol·L-1的KMnO4标准溶液滴定至终点,消耗标准溶液30.00 mL。在上述滴定过C2O42-的保留液中加入足量锌粉,加热至黄色消失,过滤洗涤,滤液及洗涤液再用0.02000 mol·L-1的KMnO4标准溶液滴定至终点,消耗标准溶液5.00 mL。则该产品的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下各种模型图都由C、H、O、N中的一种或多种元素构成。下列说法正确的是( )

A. 图①是球棍模型,其化学式为:C3H7O2N,是一种蛋白质
B. 图②是比例模型,其化学式为:C9H13NO,该物质既能与盐酸反应,又能与氢氧化钠溶液反应
C. 图③是球棍模型,其化学式为:C9H10O3,1 mol该物质能消耗3 mol氢氧化钠
D. 图③是比例模型,其化学式为:C9H13ON,能够发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学活动小组设计以下装置进行不同的实验。其中a为用于鼓入空气的气囊,b 为螺旋状铜丝,c中盛有冰水。

(1)若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是____________(填序号),该装置中应加入试剂____________。从实验安全角度考虑,A装置试管中除加入反应液外,还需加入的固体物质是____________。
(2)该小组同学欲做乙醇氧化成乙醛的实验,则应选用的装置是____________(填序号),再用制得的乙醛溶液进行银镜反应,正确的操作顺序是____________(填序号)。
①向试管中滴入3滴乙醛溶液
②一边振荡一边滴入2%的稀氨水,直至最初产生的沉淀恰好溶解为止
③振荡后放入热水中,水浴加热
④在洁净的试管中加入1 mL 2%的AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼是新型无机材料中的明星元素。

(1)磷化硼是一种耐磨涂料,可由三溴化硼和三溴化磷高温下在氢气中反应合成,其化学方程式为 ______,图为磷化硼晶体结构中最小的重复单元,磷化硼的晶体类型是 ______,一个晶胞中含 ______个P原子,每个B或P均形成4个共价键,其中有一个配位键,提供空轨道的是 ______原子。
(2)氮化硼是一种重要的功能陶瓷材料,其结构与磷化硼相似,B和N相比,电负性较大的是 ______(填元素符号),其基态原子的电子排布式为 ______,氮化硼中B元素的化合价为 ______。
(3)环硼氮烷与苯是等电子体,其一氯代物有两种结构、二氯代物有四种结构,写出环硼氮烷分子结构式 ______。
(4)BF3用作有机合成中的催化剂,也用于制造火箭的高能燃料。在BF3分子中,F-B-F的键角是 ______ 度,B原子采用 ______ 杂化;BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400K、101.3Kpa时,1.5L某烃蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L(相同条件下),若a=8时,该烃可能的分子式( )
A.CH4B.C2H6C.C3H8D.C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)3—甲基—1一丁炔的结构简式为_____________
(2)![]() 的分子式为_____________
的分子式为_____________
(3)烃A在同温、同压下蒸气的密度是H2的35倍,其分子式为_____________。
(4)分子式为C8H10属于芳香烃的同分异构体共有_____________种,其中____________(填结构简式)在苯环上的一氯取代产物有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
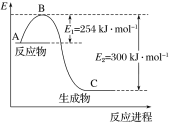
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示。下列判断不正确的是( )

A.TiCl4为共价化合物
B.NaX随 X-半径增大,离子键减弱
C.NaX均为离子化合物
D.TiF4的熔点反常升高是由于氢键的作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com