


科目:高中化学 来源: 题型:
| A、0.5molH2O2中含有6.02×1023个质子 |
| B、1molC5H12分子中含有17×6.02×1023个共用电子对 |
| C、质量均为16g 的O2和O3中都含有6.02×1023个原子 |
| D、标准状况下,11.2LHCl中含6×6.02×1023个离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁、戊五种前四周期元素,其中甲乙丙都为非金属元素,在周期表中的位置关系如图1所示.丁、戊两种元素则位于同一周期同一族,而且戊的原子序数比丁大2.
甲、乙、丙、丁、戊五种前四周期元素,其中甲乙丙都为非金属元素,在周期表中的位置关系如图1所示.丁、戊两种元素则位于同一周期同一族,而且戊的原子序数比丁大2.查看答案和解析>>
科目:高中化学 来源: 题型:
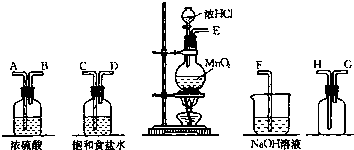
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若金属剩余,向溶液中再滴入硫酸后,金属又开始溶解 |
| B、若金属全部溶解,则溶液中一含有Fe3+ |
| C、若金属全部溶解,且产生336ml气体(标准状况),则b=0.3 |
| D、当溶液中金属离子只有Fe3+、Cu2+时,则a和b的关系没法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
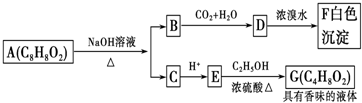
| A、根据图示可推知D为苯酚 |
| B、G的同分异构体中属于酯且能发生银镜反应的只有一种 |
| C、上述各物质中能发生水解反应的有A、B、D、G |
| D、A的结构中含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
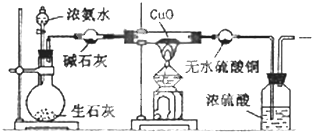
查看答案和解析>>
科目:高中化学 来源: 题型:
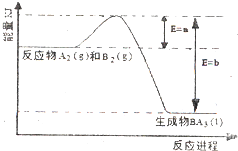 原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题:
原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com