
汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质产生的大气污染的方法是安装催化转换器,使它们发生反应生成CO2和N2。反应方程式为:2CO+2NO2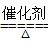 CO2+N2,其中NO2是
CO2+N2,其中NO2是
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:单选题
已知下列氧化剂均能氧化+4价的硫元素,为除去稀硫酸中混有的亚硫酸,以得到纯净的稀硫酸,应选用的最合理的氧化剂是( )
| A.KMnO4 | B.Ca(ClO)2 | C.H2O2 | D.Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述中,不正确的是
| A.还原产物为NH4+ |
| B.氧化剂与还原剂的物质的量之比为1∶8 |
| C.若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D.若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应中转移电子的物质的量不等于2 mol的是
| A.1 mol Al与含1mol H2SO4的稀硫酸溶液反应 |
| B.1mol Cu与含4mol HNO3的稀硝酸溶液反应 |
| C.1 mol MnO2与含2 mol H2O2的双氧水反应 |
| D.1 mol Cu与含2 mol H2SO4的浓硫酸共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铬铁矿的主要成分的化学式为FeO·Cr2O3,还含有SiO2、Al2O3等杂质。工业上常采用固体碱熔氧化法用铬铁矿粉制备重铬酸钾,流程为:
已知:①NaFeO2遇水强烈水解;
②重铬酸钾为橙红色针状晶体,溶于水,不溶于乙醇,有强氧化性;
③2CrO42- + 2H+ Cr2O72-+ H2O
Cr2O72-+ H2O
(1)灼烧操作一般在坩埚中进行,下列物质适合用来制作此实验坩埚材料的是
| A.铁 | B.氧化铝 | C.石英 | D.陶瓷 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A.生成40.0LN2(标准状况) | B.有0.250molKNO3被氧化 |
| C.转移电子的物质的量为2.5mol | D.被氧化的N原子的物质的量为3.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述不正确的是
| A.Li+中含有的中子数与电子数之比为2︰1 |
| B.在C2H6分子中极性共价键与非极性共价键数之比为6︰1 |
| C.常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4︰1 |
| D.5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2︰1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+Cl2―→CO2+N2+Cl-+H2O(未配平)中,如果有6 mol Cl2完全反应,则被氧化的OCN-的物质的量是 ( )。
| A.2 mol | B.3 mol | C.4 mol | D.6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com