
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图完成回收硫酸亚铁和铜的简单实验方案,回答下列问题:(流程图中无需填写)

(1)试剂①为____,操作⑥名称为_______和洗涤,其中洗涤的操作方法是_______________。为检验沉淀是否洗涤干净,可向最后一次洗涤液中加入试剂:__________。
(2)试剂⑤的化学式为_____,所发生的化学方程式为___________________________。
(3)对④和⑧的混合溶液,不选用蒸发结晶(余热蒸干)获得FeSO4·7H2O,原因是_____、________。(说出两点原因)
【答案】 铁粉 过滤 向漏斗中加蒸馏水至淹没沉淀,待水流尽,重复2-3次 BaCl2溶液 H2SO4 Fe+H2SO4 =FeSO4 +H2 ↑ 产品中混入Na2SO4杂质 产品失去部分结晶水
【解析】试题分析:本题以含有大量的FeSO4、较多的Cu2+和少量的Na+的工业废水为原料回收硫酸亚铁和金属铜为载体,考查流程的分析,物质的分离和提纯,基本实验操作。根据实验目的,①中加入过量的铁粉,发生反应Fe+Cu2+=Fe2++Cu;操作②为过滤;③中含有Cu和过量的Fe;④为含Na+的FeSO4溶液;⑤中应加入H2SO4将③中Fe溶解,反应的方程式为Fe+H2SO4=FeSO4+H2↑;操作⑥为过滤、洗涤;⑦为回收的金属Cu;⑧为FeSO4溶液;从含Na+的FeSO4的溶液中获得FeSO4·7H2O,操作⑨为加热浓缩、冷却结晶、过滤、洗涤、干燥。
(1)根据上述分析,试剂①为铁粉;操作⑥名称为过滤和洗涤,其中洗涤的操作方法是向漏斗中加蒸馏水至淹没沉淀,待水流尽,重复2~3次。为检验沉淀是否洗涤干净,可检验洗涤液中是否含SO42-,可向最后一次洗涤液中加入BaCl2溶液,若不产生白色沉淀表明洗涤干净,反之未洗涤干净。
(2)根据上述分析,试剂⑤的化学式为H2SO4,所发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑。
(3)④和⑧的混合溶液是含Na+的FeSO4溶液,对此混合液不选用蒸发结晶(余热蒸干)获得FeSO4·7H2O,原因是:若选用蒸发结晶,产品中会混入Na2SO4杂质;产品受热分解会失去部分结晶水。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】六偏磷酸钠[(NaPO3)6]是偏磷酸钠(NaPO3)的一种聚合体,其主要用于水处理、造纸、食品行业。工业上由白磷(P4:易自燃,熔点44℃,沸点280℃,有剧毒,保存在冷水中)制备六偏磷酸钠的方法如下:
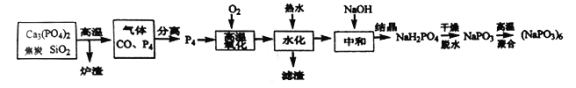
(1)“炉渣”的主要成分是___________(写化学式),该过程中氧化剂与还原剂的物质的量之比是_______________。
(2)从混合气体中分离得到P4的最佳方法是_________________。
(3)经分析“滤渣”是由白磷中的Pb、As杂质元素所形成的两种盐类,其中一种是Pb3(PO4)2,则另一种是_______________ (写化学式)。
(4)若直接将白磷与足量浓NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体。写出该化学方程式____________________。
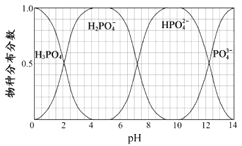
(5)已知磷酸中含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液pH的关系如图所示,则“中和”过程中应加入NaOH调节溶液的pH值为________________。若pH过低,则造成的结果是_________________。
(6)经定量分析,毎100.00g产品的有效磷(以P2O5计)含量是66.50g (其它杂质为非磷酸盐成分),则该产品的纯度是__________________。(已知:NaPO3的相对分子质量为M1,P2O5的相对分子质量为M2,结果不必化简,列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属的叙述中,正确的是
A. 金属钠着火时,可用水或泡沫灭火器灭火
B. 碱金属单质都可保存在煤油中
C. 钠离子核外电子数比钠原子核外电子数少
D. 碱金属中密度最小、熔沸点最高的是铯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中错误的是
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.原电池放电时,电流的方向是从正极经导线到负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是:( )
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
已知过程②发生反应的化学方程式为Cl2+2KI===2KCl+I2

某化学兴趣小组将上述流程②③设计成如下图所示操作。
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①_____________ ③_____________
(2)F中下层液体的颜色为_____色,上层液体中溶质的主要成分为_____。(填化学式)
(3)在灼烧过程中,使用到的实验仪器有(除泥三角外)_______________(填序号)。
①试管 ②坩埚 ③坩埚钳 ④蒸发皿 ⑤酒精灯
(4)为获取晶体碘,该兴趣小组设计如下两个装置图:
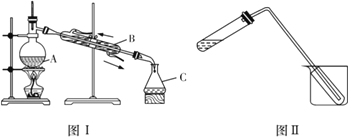
①图Ⅰ中仪器A、C的名称分别是________、________。该装置中的错误之处为___________。
②实验时仪器A中除加入一定量碘有机溶液外,还需加入少量________,其作用是_________ 。
③图Ⅱ装置可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图Ⅰ完全相同。该装置中使用的玻璃导管较长,其作用是_________;烧杯中还应盛有的物质是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)与16g氧气所含原子总数相同的氨气是_____________g;在相同条件下,在5.6g氮气中应添加___________g氨气所组成的混合气体与16g氧气所占的体积相等。
(2)把__________g NaOH溶解在90g水中,才能使得每10个水分子中有1个Na+。
(3)质量之比为16∶7∶6的三种气体SO2、CO、NO,氧原子个数之比为________。
(4)某气体氧化物的化学式为RO2,在标准状况下,0.92g该氧化物的体积为448mL,则该氧化物的摩尔质量为________。
(5)8.5g氢氧根离子含有的电子数目为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(密度为1.84 g/mL)配制1 mol·L-1的稀H2SO4100mL,配制过程中可能用到下列仪器:
①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒。按使用出现的先后顺序排列正确的是
A. ②⑥③⑦⑤ B. ④③⑤⑦⑥ C. ①③⑦⑤⑥ D. ②⑤⑦⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美、英研究人员相继宣布“去除排斥基因”的猪已经降生。人们可以利用这种猪大量“生产”适用于移植手术的器官。在此之前如果把猪器官移植给人体,人体的免疫系统能识别猪细胞上的X物质,从而发生强烈的排异反应,X物质所处的位置和化学成分分别是( )
A. 细胞膜类脂 B. 细胞膜糖与蛋白质的复合物
C. 细胞核脱氧核糖核酸 D. 细胞质蛋白质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com