
【题目】用![]() 表示阿伏加德罗常数,下列叙述正确的是( )
表示阿伏加德罗常数,下列叙述正确的是( )
A.3molFe在过量的纯氧中完全燃烧,转移的电子数为![]()
B.52g苯乙烯中含有的碳碳双键数目为![]()
C.标准状况下,![]() 和
和![]() 的混合气体的分子数目为
的混合气体的分子数目为![]()
D.![]() 溶液中
溶液中![]() 和
和![]() 的总数为
的总数为![]()
科目:高中化学 来源: 题型:
【题目】部分难溶物的颜色和常温下的Ksp如下表所示:
Cu(OH)2 | CuOH | CuCl | Cu2O | |
颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
Ksp(25 ℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | — |
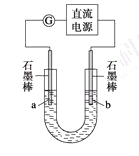
某研究性学习小组对电解食盐水进行了如下探究:
实验Ⅰ装置如图所示,接通电源后,发现a、b电极上均有气泡产生。
(1)电解过程中的总离子反应方程式为_________________________________________。
(2)为了确定电源的正、负极,下列操作一定行之有效的是_______。
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图所示。
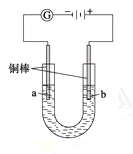
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10 min后,最靠近a极的白色沉淀开始变成红色;
④12 min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色。
(3) a极发生的电极反应方程式为________________________________________________________。
(4) 电解5 min后,b极发生的电极反应方程式为___________________________________________。
(5)12 min后,b极附近出现的橙黄色沉淀的成分是_____,原因是___________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱试样中含有NaCl杂质,有多种方法测定试样中纯碱的质量分数。
![]() 气体法
气体法
可用图中的装置进行实验:

主要实验步骤如下:
![]() 按图组装仪器,并检查装置的气密性;
按图组装仪器,并检查装置的气密性;
![]() 将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
![]() 从A处导管缓缓鼓入一定量的空气;
从A处导管缓缓鼓入一定量的空气;
![]() 称量盛有碱石灰的U型管的质量,得到b克;
称量盛有碱石灰的U型管的质量,得到b克;
![]() 从分液漏斗滴入
从分液漏斗滴入![]() 的盐酸,直到不再产生气体时为止;
的盐酸,直到不再产生气体时为止;
![]() 再从A处导管缓缓鼓入一定量的空气;
再从A处导管缓缓鼓入一定量的空气;
![]() 再次称量盛有碱石灰的U型管的质量,得到c克;
再次称量盛有碱石灰的U型管的质量,得到c克;
![]() 重复步骤
重复步骤![]() 和
和![]() 的操作,直到U型管的质量基本不变,为d克;
的操作,直到U型管的质量基本不变,为d克;
请填空和回答问题:
![]() 、D两装置中分别装什么试剂C: ______ D: ______
、D两装置中分别装什么试剂C: ______ D: ______
![]() 装置中干燥管F的作用是 ______
装置中干燥管F的作用是 ______
![]() 该试样中纯碱的质量分数的计算式为 ______
该试样中纯碱的质量分数的计算式为 ______
![]() 沉淀法
沉淀法
称取![]() 克样品完全溶于水后加足量的
克样品完全溶于水后加足量的![]() 溶液,然后过滤、洗涤、干燥称重得
溶液,然后过滤、洗涤、干燥称重得![]() 克固体,在该实验洗涤操作中如何检验固体已洗干净 ______ 。
克固体,在该实验洗涤操作中如何检验固体已洗干净 ______ 。
![]() 滴定法
滴定法
准确称取![]() 克样品,溶于水配成250mL溶液,量取25.00mL溶液于锥形瓶中,加入几滴酚酞作指示剂,用
克样品,溶于水配成250mL溶液,量取25.00mL溶液于锥形瓶中,加入几滴酚酞作指示剂,用![]() 的盐酸溶液进行滴定,到达终点时共消耗20.00mL盐酸,则样品中纯碱的质量分数为 ______ ,以下实验操作导致测量结果偏低的是 ______
的盐酸溶液进行滴定,到达终点时共消耗20.00mL盐酸,则样品中纯碱的质量分数为 ______ ,以下实验操作导致测量结果偏低的是 ______
A.配制样品溶液定容时俯视容量瓶刻度线
B.配制样品溶液定容后摇匀,发现液面低于容量瓶刻度线,于是又加水至刻度线
C.用盐酸滴定时滴定前仰视刻度线读数,滴定终点时俯视刻度线读数
D.滴定前锥形瓶中有水
E.酸式滴定管滴定前有气泡,而滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁((C6H11O7)2Fe)是常用的补铁剂,易溶于水,几乎不溶于乙醇。用下图装置制备FeCO3,并利用FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。回答下列问题:
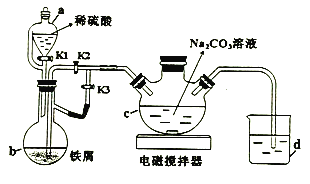
(1)a的名称为_________。
(2)打开a中K1、K3,关闭K2,一段时间后,关闭K3,打开K2。在_________(填仪器标号)中制得碳酸亚铁。实验过程中产生的H2作用有_________、____________。(写2条)
(3)将制得的碳酸亚铁浊液过滤、洗涤。如过滤时间过长会发现产品部分变为红褐色。用化学方程式说明原因____________。
(4)将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。加入乙醇的目的是_________________。
(5)用 NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,离子方程式为______________,此法产品纯度更高,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容积为2L的密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示。
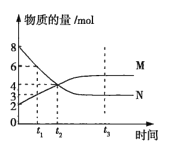
(1)该反应的化学方程式为___。
(2)比较t2、t3时正、逆反应速率的大小(用v正、v逆表示):t2时__;t3时__。
(3)若t2=2min,则反应开始至t2时,M的平均反应速率为__。
(4)下列说法可以表明该反应已达到平衡状态的是__(填序号)。
A.混合气体的密度不变
B.正、逆反应速率都等于零
C.M、N的物质的量浓度不变
D.M、N的物质的量浓度相等
(5)t3时化学反应达到平衡状态,请写出3个可以提高此时该反应化学反应速率的方法:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬矿石(主要成分为Cr2O3,还有Al2O3、SiO2等杂质)为原料制取红矾钠 (Na2Cr2O7·2H2O)的流程如图所示。

已知:I.Cr2O3在碱性条件下易被氧化;
II.高温条件下,Al2O3与Na2CO3发生的反应为:Al2O3 +Na2CO3=2NaAlO2 +CO2↑;
III.2CrO42-+2H+![]() Cr2O72- +H2O K=1.0×1012
Cr2O72- +H2O K=1.0×1012
(1)“煅烧”时,Cr2O3参加反应的化学方程式为_____。若“煅烧”操作最适宜的温度是800~900℃,则在实验室中进行此项操作时,应选择_____坩埚(填字母)。
a.陶瓷 b.玻璃 c.石英 d.铁
(2)流程中可循环利用的物质除CO2外还有_____(填化学式)。
(3)“过滤II”所得沉淀主要有______(填化学式)。
(4)由Na2Cr2O7溶液制备红矾钠的具体实验操作有_____,经洗涤、干燥得到红矾钠样品。
(5)“电解”时,利用以下装置将Na2CrO4溶液转化为Na2Cr2O7溶液,当a、b均为石墨电极时,a电极的电极反应式为____。若初始加入电解池中的c (Na2CrO4)=1.0mol·L-l,随着“电解”的进行,当溶液pH=6时,Na2CrO4的转化率为______(忽略电解过程中溶液体积变化)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为: 3Z = 3X+2Y
B. t0时,X、Y、Z的质量不再改变
C. t0时,Z的浓度为1.2 mol/L
D. t0时,反应停止,反应速率为0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com