
【题目】已知某纯碱试样中含有NaCl杂质,有多种方法测定试样中纯碱的质量分数。
![]() 气体法
气体法
可用图中的装置进行实验:

主要实验步骤如下:
![]() 按图组装仪器,并检查装置的气密性;
按图组装仪器,并检查装置的气密性;
![]() 将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
![]() 从A处导管缓缓鼓入一定量的空气;
从A处导管缓缓鼓入一定量的空气;
![]() 称量盛有碱石灰的U型管的质量,得到b克;
称量盛有碱石灰的U型管的质量,得到b克;
![]() 从分液漏斗滴入
从分液漏斗滴入![]() 的盐酸,直到不再产生气体时为止;
的盐酸,直到不再产生气体时为止;
![]() 再从A处导管缓缓鼓入一定量的空气;
再从A处导管缓缓鼓入一定量的空气;
![]() 再次称量盛有碱石灰的U型管的质量,得到c克;
再次称量盛有碱石灰的U型管的质量,得到c克;
![]() 重复步骤
重复步骤![]() 和
和![]() 的操作,直到U型管的质量基本不变,为d克;
的操作,直到U型管的质量基本不变,为d克;
请填空和回答问题:
![]() 、D两装置中分别装什么试剂C: ______ D: ______
、D两装置中分别装什么试剂C: ______ D: ______
![]() 装置中干燥管F的作用是 ______
装置中干燥管F的作用是 ______
![]() 该试样中纯碱的质量分数的计算式为 ______
该试样中纯碱的质量分数的计算式为 ______
![]() 沉淀法
沉淀法
称取![]() 克样品完全溶于水后加足量的
克样品完全溶于水后加足量的![]() 溶液,然后过滤、洗涤、干燥称重得
溶液,然后过滤、洗涤、干燥称重得![]() 克固体,在该实验洗涤操作中如何检验固体已洗干净 ______ 。
克固体,在该实验洗涤操作中如何检验固体已洗干净 ______ 。
![]() 滴定法
滴定法
准确称取![]() 克样品,溶于水配成250mL溶液,量取25.00mL溶液于锥形瓶中,加入几滴酚酞作指示剂,用
克样品,溶于水配成250mL溶液,量取25.00mL溶液于锥形瓶中,加入几滴酚酞作指示剂,用![]() 的盐酸溶液进行滴定,到达终点时共消耗20.00mL盐酸,则样品中纯碱的质量分数为 ______ ,以下实验操作导致测量结果偏低的是 ______
的盐酸溶液进行滴定,到达终点时共消耗20.00mL盐酸,则样品中纯碱的质量分数为 ______ ,以下实验操作导致测量结果偏低的是 ______
A.配制样品溶液定容时俯视容量瓶刻度线
B.配制样品溶液定容后摇匀,发现液面低于容量瓶刻度线,于是又加水至刻度线
C.用盐酸滴定时滴定前仰视刻度线读数,滴定终点时俯视刻度线读数
D.滴定前锥形瓶中有水
E.酸式滴定管滴定前有气泡,而滴定后气泡消失
【答案】水 浓硫酸 防止空气中的![]() 和水气进入U型管中
和水气进入U型管中 ![]() 取最后的洗涤液于试管中加入稀
取最后的洗涤液于试管中加入稀![]() 酸化,然后加入几滴
酸化,然后加入几滴![]() 溶液,若没有白色沉淀证明已洗干净,否则没有洗干净
溶液,若没有白色沉淀证明已洗干净,否则没有洗干净 ![]() B、C
B、C
【解析】
![]() 气体法
气体法
![]() 装置C中是水吸收二氧化碳气体中的氯化氢,装置D中是浓硫酸,吸收二氧化碳中的水蒸气;
装置C中是水吸收二氧化碳气体中的氯化氢,装置D中是浓硫酸,吸收二氧化碳中的水蒸气;
![]() 装置F是为了防止空气中水蒸气和二氧化碳进入装置E使测定结果产生误差;
装置F是为了防止空气中水蒸气和二氧化碳进入装置E使测定结果产生误差;
![]() 生成二氧化碳质量为(d-b)g,结合碳元素守恒计算碳酸钠的质量分数;
生成二氧化碳质量为(d-b)g,结合碳元素守恒计算碳酸钠的质量分数;
![]() 沉淀法
沉淀法
要检验实验洗涤操作中固体已洗干净,只要检验最后的洗涤液中不含Cl-即可;
![]() Ⅲ
Ⅲ![]() 滴定法
滴定法
量取25.00mL溶液于锥形瓶中,加入几滴酚酞作指示剂,用![]() 的盐酸溶液进行滴定,到达终点时共消耗20.00mL盐酸,发生的反应为:
的盐酸溶液进行滴定,到达终点时共消耗20.00mL盐酸,发生的反应为:![]() ,依据化学反应的定量关系计算碳酸钠的物质的量得到样品中的碳酸钠的质量,计算得到碳酸钠的质量分数;
,依据化学反应的定量关系计算碳酸钠的物质的量得到样品中的碳酸钠的质量,计算得到碳酸钠的质量分数;
依据滴定过程中标准溶液体积的变化,结合n(Na2CO3)=c(标准)V(标准)分析判断产生的误差,
A.配制样品溶液定容时俯视容量瓶刻度线,加入水的量少未达到刻度线;
B.配制样品溶液定容后摇匀,发现液面低于容量瓶刻度线,于是又加水至刻度线,导致溶液超过刻度线,浓度减小;
C.用盐酸滴定时滴定前仰视刻度线读数读取读数增大,滴定终点时俯视刻度线读数,读取数值减小;
D.滴定前锥形瓶中有水对测定结果无影响;
E.酸式滴定管滴定前有气泡,而滴定后气泡消失,标准溶液体积增大,测定结果增大.
![]() 气体法
气体法
![]() B装置中反应产生的CO2中混有HCl和H2O(g),而碱石灰不仅吸收CO2,也吸收HCl和H2O(g),引起实验误差,装置C中是水吸收二氧化碳气体中的氯化氢,装置D中是浓硫酸,吸收二氧化碳中的水蒸气,C、D两装置中分别装的试剂为:水和浓硫酸,
B装置中反应产生的CO2中混有HCl和H2O(g),而碱石灰不仅吸收CO2,也吸收HCl和H2O(g),引起实验误差,装置C中是水吸收二氧化碳气体中的氯化氢,装置D中是浓硫酸,吸收二氧化碳中的水蒸气,C、D两装置中分别装的试剂为:水和浓硫酸,
故答案为:水,浓硫酸;
![]() 装置F是为了防止空气中水蒸气和二氧化碳进入装置E使测定结果产生误差,
装置F是为了防止空气中水蒸气和二氧化碳进入装置E使测定结果产生误差,
故答案为:防止空气中的![]() 和水气进入U型管中;
和水气进入U型管中;
![]() 生成二氧化碳质量为(d-b),结合碳元素守恒计算碳酸钠的质量分数
生成二氧化碳质量为(d-b),结合碳元素守恒计算碳酸钠的质量分数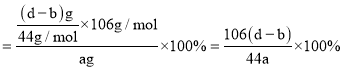 ,
,
故答案为:![]() ;
;
![]() 沉淀法
沉淀法
要检验实验洗涤操作中固体已洗干净,只要检验最后的洗涤液中不含Cl-即可,实验设计为:取最后的洗涤液于试管中加入稀![]() 酸化,然后加入几滴
酸化,然后加入几滴![]() 溶液,若没有白色沉淀证明已洗干净,否则没有洗干净,
溶液,若没有白色沉淀证明已洗干净,否则没有洗干净,
故答案为:取最后的洗涤液于试管中加入稀![]() 酸化,然后加入几滴
酸化,然后加入几滴![]() 溶液,若没有白色沉淀证明已洗干净,否则没有洗干净;
溶液,若没有白色沉淀证明已洗干净,否则没有洗干净;
![]() 滴定法
滴定法
量取25.00mL溶液于锥形瓶中,加入几滴酚酞作指示剂,用![]() 的盐酸溶液进行滴定,到达终点时共消耗20.00mL盐酸,发生的反应为:
的盐酸溶液进行滴定,到达终点时共消耗20.00mL盐酸,发生的反应为:![]() ,依据化学反应的定量关系计算碳酸钠的物质的量得到样品中的碳酸钠的质量,
,依据化学反应的定量关系计算碳酸钠的物质的量得到样品中的碳酸钠的质量,
![]() ,
,
1 1
n ![]()
![]()
250mL溶液中含碳酸钠物质的量![]()
碳酸钠的质量分数![]() ,
,
依据滴定过程中标准溶液体积的变化,结合n(Na2CO3)=c(标准)V(标准)分析判断产生的误差,
A.配制样品溶液定容时俯视容量瓶刻度线,加入水的量少未达到刻度线,溶液浓度偏大,V(标准)偏大,实验测定结果偏高;
B.配制样品溶液定容后摇匀,发现液面低于容量瓶刻度线,于是又加水至刻度线,导致溶液超过刻度线,溶液浓度偏小,V(标准)偏小,实验测定结果偏低;
C.用盐酸滴定时滴定前仰视刻度线读数读取读数增大,滴定终点时俯视刻度线读数,V(标准)偏小,实验测定结果偏低;
D.滴定前锥形瓶中有水对测定结果无影响;
E.酸式滴定管滴定前有气泡,而滴定后气泡消失,V(标准)偏大,实验测定结果偏大;
故答案为:![]() ;B、C。
;B、C。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
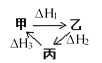
A.甲、乙、丙三物质转化如图所示,则![]()
B.1molCO完全燃烧生成稳定氧化物放出热量为![]() ,则2
,则2 ![]()
![]() ,
,![]()
C.若![]() ,
,![]() ,故在某容器中充入
,故在某容器中充入![]() 与
与![]() 充分反应后,放出的热量为
充分反应后,放出的热量为![]()
D.常温下,稀HCl和稀NaOH溶液反应生成![]() 放出热量为
放出热量为![]() ,其热化学方程式为
,其热化学方程式为![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m、n、x、y四种主族元素在周期表的相对位置如图所示。已知它们的原子序数总和为46,则:
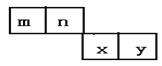
(1)元素n的气态氢化物的电子式为___,基态n原子的核外共有__种不同运动状态的电子。
(2)m与y所形成的化合物含___键,属___分子。(填“极性”或“非极性”)
(3)x位于周期表的第___周期第___族;其简单离子的离子结构示意图为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入一定量SO2、O2发生反应2SO2(g)+O2(g)![]() 2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
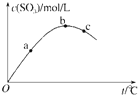
A. 该反应△H>0 B. SO2转化率:a>b>c
C. 化学反应速率:c>b>a D. 平衡常数K:b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况,离子可能大量共存的是( )
A.Al3+、Na+、Cl-、CO32-
B.25℃,水电离出的OH-浓度为10-11mol/L的溶液中:K+、Na+、SO32-、NO3-
C.![]() =10-2溶液中:Cu2+、Na+、Cl-、NO3-
=10-2溶液中:Cu2+、Na+、Cl-、NO3-
D.无色溶液中:H+、Fe2+、Cl-、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(s)+nB(g)![]() eC(g)+fD(g),当反应过程中其他条件不变时,C的质量分数(c%)与温度(T)和压强(p)的关系如图所示。下列叙述正确的是( )
eC(g)+fD(g),当反应过程中其他条件不变时,C的质量分数(c%)与温度(T)和压强(p)的关系如图所示。下列叙述正确的是( )
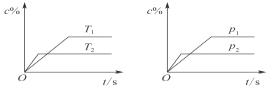
A. 达到平衡后,若使用催化剂,C的质量分数将增大
B. 达到平衡后,增加A的量有利于化学平衡向正方向移动
C. 化学方程式中n>e+f
D. 达到平衡后,若升高温度,化学平衡向逆方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型可逆电池的工作原理如下图所示。放电时总反应为:Al+3Cn(AlCl4)+4AlCl4-![]() 4Al2Cl7-+3Cn(Cn表示石墨)。
4Al2Cl7-+3Cn(Cn表示石墨)。

下列说法正确的是
A. 放电时负极反应为:2Al-6e-+7Cl-= Al2Cl7-
B. 放电时AlCl4-移向正极
C. 充电时阳极反应为: AlCl4-e-+Cn=Cn(AlCl4)
D. 电路中每转移3mol电子,最多有1molCn(AlCl4)被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数,下列叙述正确的是( )
表示阿伏加德罗常数,下列叙述正确的是( )
A.3molFe在过量的纯氧中完全燃烧,转移的电子数为![]()
B.52g苯乙烯中含有的碳碳双键数目为![]()
C.标准状况下,![]() 和
和![]() 的混合气体的分子数目为
的混合气体的分子数目为![]()
D.![]() 溶液中
溶液中![]() 和
和![]() 的总数为
的总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法不正确的是

A.过程I得到的Li3N的电子式为 ![]()
B.过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C.反应Ⅲ中能量转化的方式是电能转变为化学能
D.过程I、Ⅱ、Ⅲ均为氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com