
已知:H2(g)+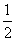 O2(g)===H2O(g);
O2(g)===H2O(g);
ΔH=-Q1 kJ·mol-1
2H2(g)+O2(g)===2H2O(l);ΔH=-Q2 kJ·mol-1
则下列判断正确的是 ( )
A.2Q1>O2 B.Q1>2Q2 C.2Q1<Q2 D.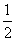 Q2=Q1
Q2=Q1
科目:高中化学 来源: 题型:
实验室内有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
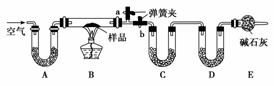
(1)实验时,B中发生反应的化学方程式为___________________________________
________________________________________________________________________。
(2)装置C、D中盛放的试剂分别为C________________,D________________(供选试剂为浓硫酸、无水CaCl2、碱石灰)。
(3)E装置中的仪器名称是________,它在该实验中的主要作用是__________________________。
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将________(填“偏高”、“偏低”或“无影响”)。
(5)反应前,在B装置中通入空气可减少实验误差,操作方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
4NH3(g)+5O2(g)  4NO(g)+6H2O(g);ΔH=-1025kJ·mol-1,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
4NO(g)+6H2O(g);ΔH=-1025kJ·mol-1,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
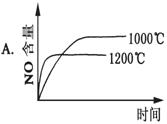
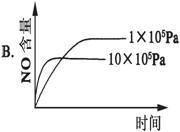
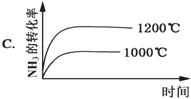
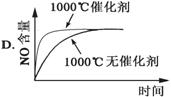
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验与对应的图象符合的是
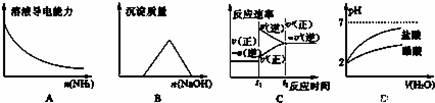
A.向一定量的CH3COOH溶液中通入NH3至过量
B.向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量
C.对于达到平衡状态的N2(g)+3H2(g) 2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡
2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡
D.将pH=2的盐酸和醋酸分别加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
设C+CO2===2CO(正反应为吸热反应),反应速率为v1;N2+3H2===2NH3(正反应为放热反应),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方法或操作正确且能达到预期目的的是:
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| ⑤ | 判断不同反应的反应速率的大小 | 比较不同反应的反应热数据的大小 |
A.①②④ B.②③④ C.①③④ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:C(s)+O2(g)=CO2(g) △H=akJ·mol—1;
2CO(g)+O2(g)=2CO2(g) △H=bkJ·mol—1;
2Cu2O(s)+O2(g)=4CuO(s) △H=ckJ·mol—1.
方法Ⅰ制备过程会产生有毒气体,写出制备反应的热化学方程式 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备
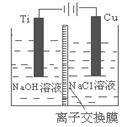 纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应
纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应
式为 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大, (填操作名称)可分离出颗粒过大的Cu2O。
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:
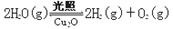 ⊿H >0
⊿H >0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
下列叙述正确的是( )
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)⇌2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间生成amol A,同时消耗1.5amol B;
③各组分的浓度不再变化;
④混合气体的密度不再变化;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦混合气体的平均摩尔质量不再变化;
⑧A、B、C的分子数目比为2:3:2.
|
| A. | ⑤⑥⑧ | B. | ②⑤⑧ | C. | ①③④ | D. | ②④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com