
【题目】用0.1000mol/L的标准盐酸分别滴定20.00mL的0.1000mol/L氨水和20.00mL的0.1000mol/L氢氧化钠溶液的滴定曲线如图所示,横坐标为滴定百分数(滴定用量/总滴定用量),纵坐标为滴定过程中溶液pH,甲基红是一种酸碱指示剂,变色范围为4.4-6.2,下列有关滴定过程说法正确的是
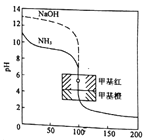
A. 滴定氨水溶液当滴定分数为50%时,各离子浓度间存在关系:c(NH4+)+c(H+)=c(OH-)
B. 滴定分数为100%时,即为滴定过程中反应恰好完全的时刻
C. 从滴定曲线可以判断,使用甲基橙作为滴定过程中的指示剂准确性更佳
D. 滴定氨水溶液当滴定分数为150%时,所得溶液中离子浓度有大小关系c(Cl-)>c(H+)
科目:高中化学 来源: 题型:
【题目】一种用烃A合成高分子化合物N的流程如下:

经测定烃A在标准状况下的密度为1.16 g·L-1;F和G是同系物;核磁共振氢谱显示有机物H中有四种峰,且峰值比为3∶3∶1∶1。
已知:Ⅰ.![]()
![]()

Ⅱ.![]() +R1Cl
+R1Cl![]()
![]() +HCl
+HCl
Ⅲ.R1CHO+R2CH2CHO![]()
![]() +H2O
+H2O
(R1、R2、R3代表烃基或氢原子)
(1) 写出A的结构简式:___________。
(2) H中所含官能团的名称是___________。
(3) H→I、M→N的反应类型分别是______、______。
(4) 写出F和G反应生成H的化学方程式:________________________________。
(5) E和I反应生成M的化学方程式为_________________________________。
(6) 芳香族化合物Q是M的同分异构体,与M具有相同官能团,且水解可以生成 2-丙醇,则Q有____种(不考虑立体异构)。
(7) 请参考以上流程,依照:原料![]() ……→产物模式,设计一个由乙烯合成2-丁烯醛的流程,无机试剂自选。
……→产物模式,设计一个由乙烯合成2-丁烯醛的流程,无机试剂自选。
____________________________________________________________________________________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,向20. 00 mL 0.1000 mol·L-1的醋酸溶液中逐滴加入0.1000mol·L-1的NaOH溶液,测得混合溶液的温度变化如图。下列相关说法正确的是( )

A. 若a点溶液呈酸性,此时:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-)
B. 从a到b:![]() 逐渐增大
逐渐增大
C. 水的电离程度:b点<c点
D. 溶液的PH值:a点<c点<b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g。请回答下列问题:

(1)电源中Y电极为直流电源的__________极。
(2)pH变化:A:________B:________ C:_________(填“增大”、“减小”或“不变”)。
(3)若A中KCl溶液的体积是200 mL,电解后,溶液的pH为__________(设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol·L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA
B. 标准状况下,11.2 L CCl4中含有的分子数目为0.5NA
C. 28 g聚乙烯中含有的碳原子数目为2NA
D. 1 mol CH5+中含有的电子数目为11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Ksp[(CH3)2NH)]=l.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
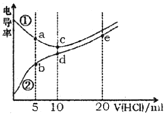
A. 曲线①代表滴定二甲胺溶液的曲线
B. a点溶液中:c[(CH3)2NH2+]>c[CH3]2NH·H2O]
C. d点溶液中:c(H+)=c(OH-)+c[CH3]2NH·H2O]
D. b、c、e三点的溶液中,水的电离程度最大的是b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为___________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)___________。
(3)YX4M的电子式为___________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为____________________。
(4)X、Z两元素形成的原子个数比为1:1的化合物中含有的化学键类型为__________。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式为______,并写出其所有可能的结构简式:__________________。
(2)某烷烃的相对分子质量为128,该烷烃的化学式为__________________。
(3)在120 ℃和101 kPa的条件下,某气态烃和一定质量的氧气混合,点燃完全反应后再恢复到原来的温度时,气体体积不变,则该烃分子内的氢原子个数______。
A.小于4 B.大于4
C.等于4 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定100mL浓度均为O.1mol/L的三种酸(HM、HN和HR)溶液,滴定的曲线如图所示,下列判断错误的是

A. 三种酸的电离常数关系:KHM>KHN>KHR
B. pH=7时,三种溶液中:c(M-)>c(N-)>c(R-)
C. 当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR)=c(OH-)-c(H+)
D. 滴定至P点时,溶液中:c(HN)>c(N-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com