
����Ŀ����״���£��ݻ�ΪVmL����ƿ����NH3����NAΪ����٤��������ֵ��
��1����������ʱ������ƿ������Ϊa g������NH3ʱ����ƿ������Ϊ____________
��2����ƿ������ԭ�ӵ�������______________
��3����֪NH3���ܶȱȿ���С����������ˮ��������ˮ�γɵ���Һ��Ϊ��ˮ������ƿ�е�NH3����Ȫʵ�飬ˮ������ƿ��������Һ���ܶ�Ϊ��g/mL������NH3û����ʧ������Һ�����ʵ���������Ϊ______�����ʵ���Ũ��Ϊ_______mol/l
���𰸡���![]() ��g
��g ![]()
![]()
![]()
��������
��1����״���£� VmLNH3�����ʵ���Ϊ ����NH3������Ϊ
����NH3������Ϊ![]() ����������ʱ������������Ϊ
����������ʱ������������Ϊ![]() ��������ƿ������Ϊmg����a=(m+
��������ƿ������Ϊmg����a=(m+![]() )g������m=(a-
)g������m=(a-![]() )g��������NH3������ƿ��������Ϊmg+
)g��������NH3������ƿ��������Ϊmg+![]() = a-
= a-![]() +
+![]() =(
=(![]() )g��
)g��
��2��NH3�����ʵ���Ϊ![]() ����ԭ�ӵ������ʵ���Ϊ
����ԭ�ӵ������ʵ���Ϊ![]() ��4=
��4=![]() mol��ԭ������Ϊ
mol��ԭ������Ϊ![]() ��
��
��3��������ƿ���ݻ�Ϊ1L����NH3�����Ϊ1L��������Ȫʵ�����Һ���ҲΪ1L����״���£�1L NH3�����ʵ���Ϊ1/22.4mol������Ϊ17/22.4g��1L��Һ������Ϊ1000��g���������ʵ���������Ϊ �����ʵ���Ũ��Ϊ
�����ʵ���Ũ��Ϊ ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��


 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����������ͭ���뵽10.0mL2.50mol/L��ϡ�����У�������ȫ�ܽ��������ɫ��Һ�м���2.06g���ۣ������衢���ˡ�ϴ�ӡ�����Ȳ��������õ����������Ϊ1.94g��ͨ�����ݵıȽ�˵�������õ��Ĺ�����ʲô���ʣ�____��ԭ����ͭ������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״�����У���6.72LCH4����3.01��1023��HCl���ӣ���13.6gH2S����0.2molNH3�����ж������������������ȷ���ǣ� ��
a�������>��>��>�� b���ܶȢ�>��>��>��
c��������>��>��>�� d����ԭ�Ӹ�����>��>��>��
A.abcB.bcdC.cbdD.abcd
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���κ��¶��¾����Է����е���
A. 2N2(g)��O2(g)===2N2O(g) ��H����163 kJ��mol��1
B. Ag(s)��Cl2(g)===AgCl(s) ��H����127 kJ��mol��1
C. HgO(s)===Hg(l)��O2(g) ��H����91 kJ��mol��1
D. H2O2(l)===O2(g)��H2O(l) ��H����98 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ԫ����H2A��Һ������ʽ�������룺H2A![]() H����HA����HA��
H����HA����HA��![]() H����A2��������������Һ��c(H2A)������(����)
H����A2��������������Һ��c(H2A)������(����)
A. 0.01 mol��L��1��H2A��Һ
B. 0.01 mol��L��1��NaHA��Һ
C. 0.02 mol��L��1��������0.04 mol��L��1��NaHA��Һ��������Һ
D. 0.02 mol��L��1��NaOH��0.02 mol��L��1��NaHA��Һ��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������ϴ������¹�ϵ��

�����и����˵����ȷ����
A. �������봿���������ص���ϵ
B. �ֽⷴӦ�븴�ֽⷴӦ���ڲ��й�ϵ
C. ��������������������ڽ����ϵ
D. ������̼�������ڲ��й�ϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��һ���ں����ܱ������п��Բ������з�Ӧ�ϳɼ״���CO��g��+2H2��g�� ![]() CH3OH��g�� ��H
CH3OH��g�� ��H
��1�����жϷ�Ӧ�ﵽƽ��״̬��������__________(����ĸ���)��
A��2 ����(H2) = �� ��(CO)
B�����������ܶȲ���
C����������ƽ����Է�����������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
E��������CO��H2��CH3OH��Ũ��֮��Ϊ1:2:1
F��CO��H2��CH3OH������֮��Ϊ1:2:1
��2��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ1���÷�Ӧ��H_______0�������������
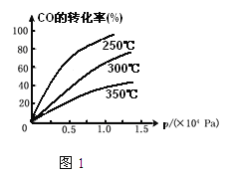
��3��һ���¶���,��4a mol H2��2a mol CO����2L���ܱ������У���ַ�Ӧ����CO��ת����Ϊ50������
�ٸ÷�Ӧ��ƽ�ⳣ��Ϊ_______________��
������ʱ�����������Ͷ��a mol CO��2a mol H2��a mol CH3OH���ж�ƽ���ƶ��ķ�����_______________���������ƶ������������ƶ����������ƶ�������
���������������������£����������ѹ����ԭ����![]() ����ԭƽ����ȣ������й�˵����ȷ����_____________������ĸ����
����ԭƽ����ȣ������й�˵����ȷ����_____________������ĸ����
A��H2��Ũ�ȼ�С�� B������Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ���
C���״������ʵ��������� D������ƽ��ʱ��![]() ������
������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ���������ý�����ȷ���ǣ� ��

ʵ�� | ʵ������ | ���� |
A | ���ձ��������������ݣ��ұ��ձ���ͭ���������� | �����ԣ�Al3+��Fe2+��Cu2+ |
B | �������Ϊ��ɫ���ұ�����Ϊ��ɫ | �����ԣ�Cl2��Br2��I2 |
C | ���ձ��г���ʯ��ˮ����ǣ�����ձ��������Ա仯 | ���ȶ��ԣ�Na2CO3��NaHCO3 |
D | ��ƿ��������������ձ���Һ������ | �ǽ����ԣ�Cl��C��Si |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼������ָ�ӿ����в��������̼�ĸ��ֿ�ѧ������ͳ�ơ������ѧ����Ϊ�ӿ����в��������̼�����������Ͽ��У��ܿ컹���Ϊһ���Ը�ȫ���ů��ʵ��������Ŀǰ NH3��(NH4)2CO3�������Ѿ���������ҵ��̼����
��1�����������в�������ΪCO2���������_________��
A��NH4Cl B��CH3CH2OH C��CaCl2 D��Na2CO3
��2����ҵ����NH3��̼�ɺϳ�CO (NH2)2����֪���ٱ�״���£�5.6L NH3������CO2��ȫ��Ӧ����NH2CO2 NH4 (s)ʱ�ų�39.8kJ����������NH2CO2 NH4 (s)= CO(NH2)2(s)+ H2O(g) ��H=+72.5 KJ��mol-1����2NH3(g)��CO2(g)=CO(NH2)2(s)+ H2O(g)�ġ�H=_________KJ��mol-1��
��3����(NH4)2CO3��̼�ķ�Ӧ���£�(NH4)2CO3(aq)��H2O(l)��CO2(g)![]() 2(NH4)2HCO3(aq)��Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��һ������(NH4)2CO3��Һ�����ܱ������У�������һ������CO2���壬����������ʼʵ���������䣬�ֱ��ڲ�ͬ�¶��£�������ͬʱ����CO2����Ũ�ȣ��õ�����ͼ������ͼ����
2(NH4)2HCO3(aq)��Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��һ������(NH4)2CO3��Һ�����ܱ������У�������һ������CO2���壬����������ʼʵ���������䣬�ֱ��ڲ�ͬ�¶��£�������ͬʱ����CO2����Ũ�ȣ��õ�����ͼ������ͼ����

��c����淴Ӧ���ʺ�d�������Ӧ���ʵĴ�С��ϵΪ����c ____����d �����������������������
��b��c��d�����ƽ�ⳣ��K b��K c��Kd ��С�����˳��Ϊ_______�����������������������
����T2��T4�¶����䣬������CO2����Ũ�ȳ����ȼ�С������ı仯���ƣ���ԭ����______________��
��4���ü�����ҺҲ�ɲ�̼���ڳ����£���0.04molCO2ͨ��200mL0.2mol/L��Na2S��Һ�У���֪��H2CO3�ĵ���ƽ�ⳣ����K1=4.3��10��7��K2=5.6��10��11��H2S�ĵ���ƽ�ⳣ����K1=5.0��10��8��K2=1.1��10��12���ش��������⣺
�ٷ�����Ӧ�����ӷ���ʽΪ___________��
�ڳ�ַ�Ӧ�����й�ϵʽ����ȷ���� ___________��
A.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
B��(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
C��c(CO32-)+ c(HCO3-)+ c(H2CO3)>c(H2S)+c(HS-)+c(S2-)
�ۼ��㷴Ӧ�����Һ��c(H2S)c(OH-)/ c(HS-)��ֵΪ___________ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com