
����Ŀ��ʵ�������÷�ͭ�Ͻ�(������������)����ȡ����ͭ����(CuSO4��5H2O)���������£�

�������������������������pH�ɲο��������ݣ�
Fe3�� | Fe2�� | Cu2�� | Al3�� | |
��ʼ����ʱ��pH | 2.2 | 7.5 | 5.2 | 3.7 |
��ȫ����ʱ��pH | 3.2 | 9.0 | 6.7 | 4.7 |
��ش�
��1�����ܽ�Ͻ�ʱ����Ļ�����2 L 3 mol��L��1�����1 L 2 mol��L��1�����϶��ɣ���Ӧ�����ɱ�״���µ�NO��������Ϊ____________L��
��2������H2O2��Ŀ����____________��
��3��Ϊ��֤��Ʒ�Ĵ��ȣ�M�������ѡ��________(����ĸ)������pH�ķ�ΧΪ____________��
a��Cu(OH)2��b��H2SO4��c��NH3��H2O��d��Na2CO3
��4����ҺD�м��������Ŀ��Ϊ_______________________________________��
��5������ҺE�Ƶ�CuSO4��5H2O��������Ҫ�IJ���Ϊ________���ᾧ�����˺��
��6��0.80g CuSO4��5H2O��Ʒ������ˮ���̵��������ߣ���Ʒ�������¶ȱ仯�����ߣ���ͼ��ʾ����ȷ��200��ʱ�������ʵĻ�ѧʽ______________��

���𰸡� 44.8L ��Fe2+������Fe3+ a 4.7��PH��5.2 ����Cu2+��ˮ�� �������� CuSO4��H2O
���������������̣���ʼ����������������ҺA�к���Cu2+��Fe2+��Al3+����ҺA�м�H2O2����Fe2+����ΪFe3+����ֹ����ʱӰ��Cu2+�����������Һ������M����pH��ȥFe3+��Al3+����ҺD����һϵ�в����õ�����ͭ������
��1�������⣬n(H+)=2L��3mol��L-1��2+1L��2mol��L-1=14 mol��n��NO3-��=1L��2mol��L-1=2 mol�����ݷ���ʽ3Cu+2NO3-+8H+=3Cu2++2NO��+4H2O�ɵã������ӹ�����NO3-��ȫ��Ӧ����������ɱ�״����NO�����Ϊ2 mol��22.4Lmol-1=44.8L��
��2��������������������H2O2��Ŀ���ǽ�Fe2+����ΪFe3+��
��3�����������Һ������M����pH��ȥFe3+��Al3+��Ϊ�˲����������ʣ�M���ѡ��a.Cu(OH)2�����ݽ������������������������pH���ݿɵ���ҪʹFe3+��Al3+��ȫ��������Cu2+������������pH�ķ�ΧΪ��4.7��pH<5.2��
��4����ΪCu2+���������ӣ�����ֱ�Ӽ�����ҺD��ٽ���ˮ�⣬�ʼ�����������Cu2+ˮ�⡣
��5��������ͭ��Һ�Ƶ�CuSO45H2O���壬��Ϊ���庬�нᾧˮ��������Ҫ����������������Ũ��������ȴ�ᾧ�����ˡ�ϴ�ӡ�����Ȳ��衣
��6��CuSO45H2O���ȵ�102��ʱ��ʼ��ʧˮ��113��ʱ�ɵõ����ȶ����м�����258��ʱ�����ֽ⣬����200��ʱʧȥ��ˮ������Ϊ0.80g-0.57g=0.23g�����ݷ�Ӧ�Ļ�ѧ����ʽ��CuSO45H2O![]() CuSO4��5-x��H2O+xH2O���ɵã�
CuSO4��5-x��H2O+xH2O���ɵã�
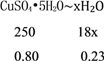
�б���ʽ�ɽ��x��4����200��ʱ�������ʵĻ�ѧʽΪCuSO4H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������ȼ�ϵ�ص�ʾ��ͼ����ͼ����ʾ��������������ȷ����(����)

A. a�缫�Ǹ�����b�缫������
B. a�缫�ĵ缫��ӦʽΪH2��2e��===2H��
C. b�缫�ĵ缫��ӦʽΪ4OH����4e��===2H2O��O2��
D. ����ȼ�ϵ�ز���Ҫ����ԭ����������ȫ�������ڵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ��Һ�������ֺ������壬250Cʱ�����ǵ����ʵ���������PH�ı仯��ͼ��ʾ�����������������
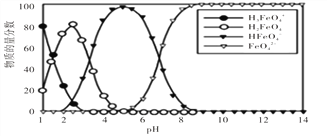
A. ��pH=5�ĸ���������Һ�м���NaOH��Һ�����ӷ���ʽΪ��HFeO4-��OH-��FeO42-��H2O
B. Ϊ��þ����ܴ����ĸ������Σ�Ӧ����pH��9
C. ��֪H3FeO4+�ĵ���ƽ�ⳣ���ֱ�Ϊ��K1=2.5��10-2 ��K2=4.8��10-4��K3=5.0��10-8����pH=4ʱ����Һ��c(HFeO4-)/c(H2FeO4)=1.2
D. pH=2ʱ����Һ�к�������Ũ�ȵĴ�С��ϵΪ:c(H2FeO4)��c(H3FeO4+)��c(HFeO4-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѡ����13�֣���1��PM2.5�����������ж����к����ʣ����������ι⻯ѧ�������⻯ѧ�����к���NOx��HCOOH��![]() ��PAN���ȶ�����Ⱦ�
��PAN���ȶ�����Ⱦ�
��1mol PAN�к��е�������ĿΪ____��PAN������Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ__________��
��NO�ܱ�FeSO4��Һ�������������[Fe(NO)(H2O)5]SO4������������������ӵ���λ��Ϊ________��
�����ӵĺ�������Ų�ʽΪ_______________��
����ͬѹǿ�£�HCOOH�ķе��CH3OCH3____������������������������ԭ����___________________��
��2��PM2.5ϸ���Ӱ���(NH4)2SO4��NH4NO3�ȡ�
��(NH4)2SO4�����и�����������������漰___________������ţ���
a�����Ӽ�
b�����ۼ�
c�����
d�����»���
e�����
��NH4NO3�������ӵĿռ乹��Ϊ_____�������ӵ�����ԭ�ӹ������_______�ӻ���
��3���ⶨ������PM2.5��Ũ�ȷ���֮һ�������������շ����������߷���Դ����85Kr����֪Kr����ľ����ṹ��ͼ��ʾ���辧������ÿ��Krԭ�ӽ����ڵ�Krԭ����m����������Krԭ��Ϊn������m/n=_____�������֣���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.ͬ����Ԫ���У���A��Ԫ�ص�ԭ�Ӱ뾶��С
B.���ɷǽ���Ԫ�ز������γ����ӻ�����
C.Ŀǰʹ�õ�Ԫ�����ڱ��У�������ں���32��Ԫ��
D.�����л�ѧ�����ѵĹ���һ�������˻�ѧ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ��������Ե����� ��
A. Ũ���� B. ���� C. �Ȼ�� D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���о���������Al2O3�ĺ�������֪���������Ҫ�ɷ���Al2O3��������Fe2O3��SiO2�ȡ�������������ȡAl2O3�Ĺ���������
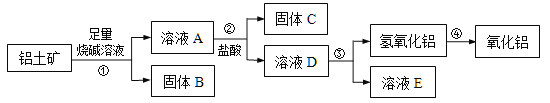
��1������B����Ҫ��;�У�д��1�����ɣ�________________��
��2�������������������м��������ռ���Һ������Ӧ�����ӷ���ʽ��________________________________��_______________________________________��
�������У���������ˮ�����������Ļ�ѧ����ʽ��________________________________��
��3����ʵ����������ù��徫ȷ����������С�鷢�������������������������ԭ������������ȣ������������Al2O3������������__________��������һλС����
��4����ҵ����ȡAlCl3��Al2O3��C��Cl2�ڸ��������·�Ӧ���������ֻ��������һ���ǻ�ԭ���������ж������÷�Ӧ�Ļ�ѧ����ʽ��_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��P��S��Cl���������������ԭ������ ��
A. P��S��Cl���Ƿǽ��� B. ���Ӳ�����ͬ
C. P��S��Clԭ�Ӱ뾶���μ�С D. P��S��Cl������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҽԺ�ڶ�ij�ಡ�˵���Һ���м��ʱ��������������Һ������ͭ��Һ���뵽����Һ�в����ȣ�����۲쵽������ɫ������˵������Һ�к���
A.ʳ��B.��C.ʳ��D.������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com