
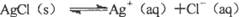 ”的理解正确的是( )。
”的理解正确的是( )。| A.说明AgCl没有完全电离,AgCl是弱电解质 |
| B.说明溶解的AgCl已完全电离,AgCl是强电解质 |
| C.说明Ag+与Cl-的反应不能完全进行到底 |
| D.说明Ag+与Cl-的反应可以完全进行到底 |
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源:不详 题型:单选题
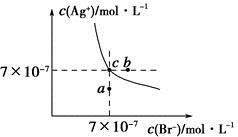
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7 Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
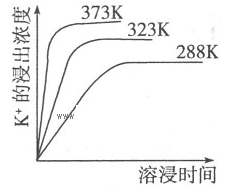
| A.向该体系中加入饱和NaOH溶液,溶解平衡向右移动 |
| B.向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 |
| C.该平衡的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO42-) |
| D.升高温度,反应速率增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
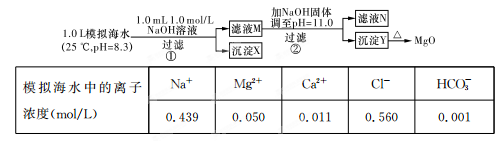
| A.沉淀物X为CaCO3 |
| B.滤液M中存在Mg2+和Ca2+ |
| C.滤液N中存在Mg2+、Ca2+ |
| D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y只有Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 |
| B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com