
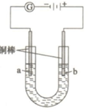
 Cu2OΪ����ɫ���壬�ж�������һ����;�㷺�IJ��ϣ� Y��֪����Cu2O�������ᣬ����������Ӧ��Cu2O+2H+=Cu2++Cu+H2O �ڲ������������ɫ�ͳ����µ�Ksp���±���ʾ��
Cu2OΪ����ɫ���壬�ж�������һ����;�㷺�IJ��ϣ� Y��֪����Cu2O�������ᣬ����������Ӧ��Cu2O+2H+=Cu2++Cu+H2O �ڲ������������ɫ�ͳ����µ�Ksp���±���ʾ��| Cu��OH��2 | CuOH | CuCl | Cu2O | |
| ��ɫ | ��ɫ | ��ɫ | ��ɫ | ש��ɫ |
| Ksp��25�� | 1.6��10-19 | 1.0��10-14 | 1.2��10-6 |
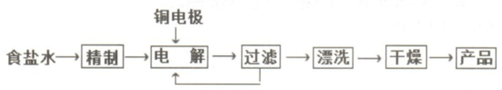
���� ������ȩ�ܱ�����������ͭ���������ᣬͬʱ����������ͭ��
��ש��ɫ����Ϊ������ͭ��������ͭ��ϡ������Һ�з�������������ԭ��������ͭ��ͭ���ʣ�
��������ͭ��ϡ���ᷴӦ�����Ȼ���ͭ��ɫ������
����1������ʳ��ˮ��Ҫ��ȥ���еĸ�þ���ӣ������ȼ����������ƽ�þ���ӳ������ټ�̼���ƽ������ӳ��������˺�����Һ���ټ�ϡ���Ὣǰ��������������ƺ�̼���Ʒ�Ӧ�����ݴ˴��⣻
��2�����ʱͭ��������ͭʧȥ���ӷ���������Ӧ������ͭ���ӣ����������ṩ�����ʵ���ɫ�����ӳ�����pHֵ������֪����ͭ��������Һ�е������ӷ�Ӧ�����Ȼ���ͭ�������ڼ��Ի������Ȼ���ͭ����ת������������ͭ����������ͭ���Էֽ��������ͭ������c��OH-��/c��Cl-��=$\frac{c��OH{\;}^{-��}c��C{u}^{+}��}{c��C{l}^{-}��c��C{u}^{+}��}$=$\frac{Ksp��CuOH��}{Ksp��CuCl��}$���м��㣻
��3������Cu2O����Ũ���ᣬ��ȫ�ܽ�õ���ɫ��Һ��CuO����Ũ���ᣬ��ȫ�ܽ�õ���ɫ��Һ�������жϣ�
��� �⣺������ȩ�ܱ�����������ͭ���������ᣬͬʱ����������ͭ����Ӧ�ķ���ʽΪ2Cu��OH��2+NaOH+CH3CHO$\frac{\underline{\;\;��\;\;}}{\;}$Cu2O��+CH3COONa+3H2O��
�ʴ�Ϊ��2Cu��OH��2+NaOH+CH3CHO$\frac{\underline{\;\;��\;\;}}{\;}$Cu2O��+CH3COONa+3H2O��
��ש��ɫ����Ϊ������ͭ��������ͭ��ϡ������Һ�з�������������ԭ��������ͭ��ͭ���ʣ����Է�Ӧ����Ϊ��Һ����ɫ��Ϊ��ɫ���к�ɫ�����
�ʴ�Ϊ����Һ����ɫ��Ϊ��ɫ���к�ɫ�����
��������ͭ��ϡ���ᷴӦ�����Ȼ���ͭ��ɫ��������Ӧ�����ӷ���ʽΪCu2O+2H++2Cl��=2CuCl��+H2O��
�ʴ�Ϊ��Cu2O+2H++2Cl��=2CuCl��+H2O��
����1������ʳ��ˮ��Ҫ��ȥ���еĸ�þ���ӣ������ȼ����������ƽ�þ���ӳ������ټ�̼���ƽ������ӳ��������˺�����Һ���ټ�ϡ���Ὣǰ��������������ƺ�̼���Ʒ�Ӧ�����������μ�����Լ�ΪNaOH��Na2CO3��HCl��
�ʴ�Ϊ��NaOH��Na2CO3��HCl��
��2���������ʱͭ��������ͭʧȥ���ӷ���������Ӧ������ͭ���ӣ��缫��ӦʽΪCu+Cl--e-=CuCl����
�ʴ�Ϊ��Cu+Cl--e-=CuCl����
�������������ṩ�����ʵ���ɫ�����ӳ�����pHֵ������֪����ͭ��������Һ�е������ӷ�Ӧ�����Ȼ���ͭ�������ڼ��Ի������Ȼ���ͭ����ת������������ͭ����Ӧ�����ӷ���ʽΪCuCl+OH-=CuOH+Cl-����������ͭ���Էֽ��������ͭ����ɫ������ɻ�ɫ�Ĺ�����c��OH-��/c��Cl-��=$\frac{c��OH{\;}^{-��}c��C{u}^{+}��}{c��C{l}^{-}��c��C{u}^{+}��}$=$\frac{Ksp��CuOH��}{Ksp��CuCl��}$=$\frac{1.0��10{\;}^{-14}}{1.2��10{\;}^{-6}}$=8.3��10-9��
�ʴ�Ϊ��CuCl+OH-=CuOH+Cl-��8.3��10-9��
��3������Cu2O����Ũ���ᣬ��ȫ�ܽ�õ���ɫ��Һ��CuO����Ũ���ᣬ��ȫ�ܽ�õ���ɫ��Һ���������ʵ�鷽��Ϊ��������Ũ���ᣬ��Һ��Ϊ��ɫ������ CuO��
�ʴ�Ϊ����������Ũ���ᣬ��Һ��Ϊ��ɫ������ CuO��
���� ���⿼����ͭ���仯�������ʵķ����жϡ����ԭ���ķ���Ӧ�á�������ת������Ҫ�ǵ���ԭ������������ת���ļ���Ӧ�ã����ջ����Լ��������������Ϣ�ǽ���Ĺؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ͬ��������ͬ�ܶȵ�O2��O3 ���� | B�� | ͬ�¶ȡ�ͬ�����O2��O3���� | ||
| C�� | ͬѹǿ��ͬ�����N2O��CO2���� | D�� | ͬ�����ͬ�ܶȵ�N2O��CO2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
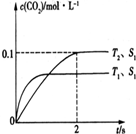 Ŀǰ����̼���š����ܹ�ע��CO2�IJ�������Ч�������ó�Ϊ��ѧ���о�����Ҫ���⣮
Ŀǰ����̼���š����ܹ�ע��CO2�IJ�������Ч�������ó�Ϊ��ѧ���о�����Ҫ���⣮
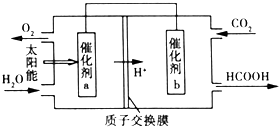
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����й©ʱ����ʪë����ס������ߴ��� | |
| B�� | NH3й©ʱ�����������ˮ�� | |
| C�� | �ء����Ż�ʱ���ô���ˮ��� | |
| D�� | ��ˮ��������Ⱦ�����ˮ������ʯ��ʯ��ĩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2�����壩+O2�����壩?2NO�����壩 ����Ӧ���� | |
| B�� | NH4HCO3�����壩?NH3�����壩+H2O�����壩+CO2�����壩 ����Ӧ���� | |
| C�� | 3O2�����壩?2O3�����壩 ����Ӧ���� | |
| D�� | 2NO2�����壩?N2O4�����壩 ����Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Rb��K��Na��Li | B�� | Cl��S��P��N | ||
| C�� | Na+��Mg2+��Al3+��H+ | D�� | I-��Br-��Cl-��F- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 | B�� | 3 | C�� | 4 | D�� | 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �л�����ؾ��в����ؽ���������Դ�����ٵ��ŵ��������Ŀ��ijPYT-﮵���ܷ�Ӧ��ͼ��������������ȷ���ǣ�������
�л�����ؾ��в����ؽ���������Դ�����ٵ��ŵ��������Ŀ��ijPYT-﮵���ܷ�Ӧ��ͼ��������������ȷ���ǣ�������| A�� | PYT����ʽΪC16H6O4 | B�� | ���ܲ���ˮ��Һ��Ϊ�������Һ | ||
| C�� | ���ʱ��������ӦΪLi-e-=Li+ | D�� | �ŵ�ʱ��Li+�������ƶ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com