
【题目】在水溶液中或 下能导电的 ,叫电解质。现有下列物质①H2SO3 ②液态SO3 ③液态的醋酸 ④铁 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧浓硫酸,属于非电解质的是____________(填写序号),写出其中电解质在水溶液中电离方程式: 。
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,用mg的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是
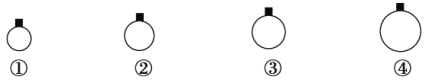
A.气球②中装的是O2
B.气球①和气球③中气体分子数相等
C.气球①和气球④中气体物质的量之比为4∶1
D.气球③和气球④中气体密度之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.6g 12C中约含有3.01×1023个碳原子
B.1 mol任何物质都含有6.02×1023个分子
C.1 mol O2的质量是32 g·mol-1
D.64 g氧相当于2 mol氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)下列关于实验的叙述中正确的有 (填字母)。
A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抹布灭火 |
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 |
C.先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 |
D.把试剂瓶中的Na2CO3溶液倒入试管中,发现取量过多,为了不浪费,又把多余的试剂倒入原试剂瓶中 |
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
F.使用分液漏斗前要检查其是否漏水
G.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液中的水全部加热蒸干
(2)某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。
现将该浓硫酸配制成100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:
a.胶头滴管 b.烧瓶 c.烧杯 d.药匙 e.量筒 f.托盘天平
请回答下列问题:
① 配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有 (写仪器名称)。
② 配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用 (填序号)规格的量筒。
a.10 mL b.50 mL c.100 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中,有下列反应发生: ①N2 + O2 = 2NO;②2NO+O2=2NO2;③3NO2 + H2O = 2HNO3 + NO;④ 2SO2+O2 = 2SO3;⑤ SO3 + H2O = H2SO4; ⑥SO2+H2O![]() H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
A. ①②③④ B. ①②③④⑦ C. ①②④⑦ D. ①②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,可以说明恒容密闭容器中的反应:P(g)+Q(g)![]() R(g)+S(g)在恒温下已达平衡状态的是
R(g)+S(g)在恒温下已达平衡状态的是
A.反应容器内压强不随时间变化
B.P和S的生成速率相等
C.反应容器内P、Q、R、S四者物质的量浓度为1:1:1:1
D.反应容器内总物质的量不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:

回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲阳离子是________。
(2)上述生产流程中加入铁屑的目的是____________________________。
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol·L-1,当溶液的pH等于________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:________________________。
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是__________________。(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图所示。下图中b是电源的________极,阴极的电极反应式________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:Li+2Li0.35NiO2![]() 2Li0.85NiO2 下列说法不正确的是
2Li0.85NiO2 下列说法不正确的是
A.放电时,负极的电极反应式:Li-e- = Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com