
【题目】工业制硝酸中的一步重要反应是NH3在加热条件下催化氧化:4NH3+5O2![]() 4NO+6H2O这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下列说法中错误的是
4NO+6H2O这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下列说法中错误的是
A.使用催化剂可以加快反应速率,提高生产效率
B.适当提高O2的浓度可以提高NH3的转化率
C.升高温度,正反应速率增大、逆反应速率减小
D.NH3的转化率为最大值时,该反应达到平衡状态
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
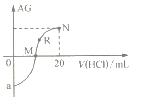
A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作和现象、结论都正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 常温下,将大小、形状形态的锌和铝分别加入到等体积 | 锌比铝活泼 |
B | 向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀 | 该溶液中一定含有 |
C | 将盐酸滴入碳酸钠溶液中,产生气泡 | 非金属性:Cl大于C |
D | 向某溶液中加入氢氧化钠溶液丙加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)有机物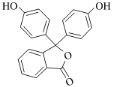 中含氧官能团的名称是________________。
中含氧官能团的名称是________________。
(2)A、B、C三种烃的化学式均为C6H10,它们的分子中均无支链或侧链。
①若A为环状,则其结构简式为:____________________。
②若B为含有双键的链状结构,且分子中不存在“![]() ”基团,则其可能的结构简式为________(任写一种)。
”基团,则其可能的结构简式为________(任写一种)。
③若C为含有三键的链状结构,则其可能的结构简式为_____________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沙罗特美是一种长效平喘药,其合成的部分路线如下:
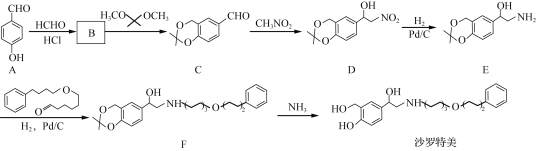
(1)F中的含氧官能团名称为____________(写两种)。
(2)C→D的反应类型为____________。
(3)B的分子式为C8H8O3,与(CH3)2C(OCH3)2发生取代反应得到物质C和CH3OH,写出B的结构简式:________。
(4)写出同时满足下列条件的E的一种同分异构体的结构简式:__________。
①分子中含有苯环,且有一个手性碳原子,不能与FeCl3发生显色反应;
②能发生水解反应,水解产物之一是α氨基酸,另一含苯环的水解产物分子中只有3种不同化学环境的氢。
(5)请写出以 、(CH3)2C(OCH3)2、CH3NO2为原料制备
、(CH3)2C(OCH3)2、CH3NO2为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是重要的资源,可以制备一系列物质。下列说法不正确的
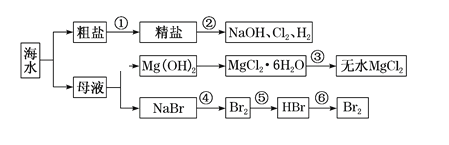
A. 要除去粗盐中SO42、Ca2+、Mg2+等杂质,步骤①中所加试剂及相关操作顺序可以是:过量NaOH溶液→过量BaCl2溶液→过量Na2CO3溶液→过滤→盐酸
B. 步骤②的反应原理为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C. 步骤③中MgCl2·6H2O置于干燥的HCl气流中加热脱水制备无水MgCl2
D. 步骤④、⑤、⑥所涉及的反应中,溴元素均发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Cu(NH3)4]SO4是一种深蓝色的配位化合物。
(1)Cu2+可被还原成Cu+,Cu+基态核外的外围电子排布式为_________________________。
(2)H元素与N元素可形成分子式为N2H2的化合物,该物质的分子具有平面结构,则该分子中N原子的杂化轨道类型为______________________。
(3)与CS2分子互为等电子体的SCN-离子的电子式为_________________。
(4)Cu可形成多种配合物,且各种配合物有广乏的用途。某Cu的配合物结构如图1所示,则该配合物中心原子Cu的配体数为____;其分子内含有的作用力有________(填序号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位健
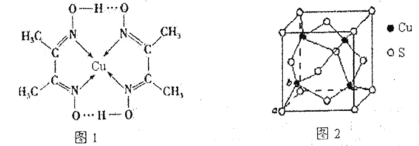
(5)Cu元素与S元素形成的一种化合物品跑如图2所示,其中S的配位数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
Ⅰ.SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s) ΔH=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ΔH=-402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-234.2kJ/mol
写出石灰石脱硫的热化学反应方程式___________________________。
Ⅱ.在一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /mol·L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~20min 时段,反应速率υ(N2O)为_____。
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=____,比较不同起始浓度时N2O的分解速率:υ(c0=0.150mol·L-1)____υ(c0=0.100 mol·L-1)(填“>、=或<”)
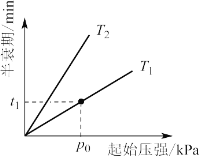
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O耗一半时所需的相应时间),则T1__T2(填“>、=或<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=__(用 p0表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下图所示装置探究碳酸和苯酚的酸性强弱,下列叙述不正确的是(部分夹持仪器省略)
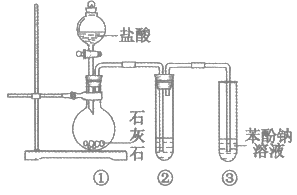
A. 打开分液漏斗旋塞,①中产生无色气泡,③中出现白色浑浊
B. ②中试剂为饱和NaHCO3溶液
C. ③中发生反应的化学方程式是![]()
D. 苯酚有弱酸性,是由于苯基影响了与其相连的羟基的活性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com