
【题目】海水是重要的资源,可以制备一系列物质。下列说法不正确的
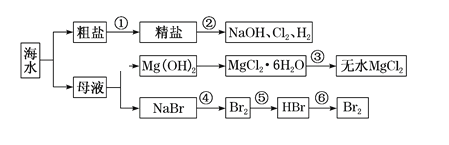
A. 要除去粗盐中SO42、Ca2+、Mg2+等杂质,步骤①中所加试剂及相关操作顺序可以是:过量NaOH溶液→过量BaCl2溶液→过量Na2CO3溶液→过滤→盐酸
B. 步骤②的反应原理为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C. 步骤③中MgCl2·6H2O置于干燥的HCl气流中加热脱水制备无水MgCl2
D. 步骤④、⑤、⑥所涉及的反应中,溴元素均发生氧化反应
【答案】D
【解析】
A. 镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,加入的碳酸钠要放在加入的氯化钡之后,过量的碳酸钠不仅可以除去溶液中的钙离子,也能除去除杂剂中的钡离子,再进行过滤操作,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最终达到目的,A项正确;
B. 根据反应原理已知,步骤②为氯碱工业步骤,B项正确;
C.步骤③氯化镁在水溶液中能水解,加热时由于HCl的挥发会促进水解,晶体直接加热不能获得无水氯化镁,应在氯化氢气流中加热失水,C项正确;
D.步骤④是溴离子被氧化为溴单质,步骤⑤是溴单质被还原为溴化氢,步骤⑥是Br-被氧化为溴单质,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】实验室制备1,2—二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。
用少量溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:

有关数据列表如下:

回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________;(填正确选项前的字母)
a. 引发反应 b. 加快反应速度
c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a 水 b 浓硫酸 c 氢氧化钠溶液 d 饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的方法是D装置中____________________________;
(4)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,溶液分层,产物应在______层(填“上”“下”);分离该有机物的方法叫_______________。
(5)若产物中有少量乙醚生成,最好用__________除去;(填正确选项前的字母)
a蒸发 b 蒸馏 c 重结晶
(6)反应过程中应用冷水冷却装置D,其主要目的是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
(1)氢气在O2中燃烧的反应是______热反应(填“放”或“吸”),这是由于反应物的总能量______生成物的总能量(填“大于”、“小于”或“等于”,下同);
(2)从化学反应的本质角度来看,氢气的燃烧是由于断裂反应物中的化学键吸收的总能量______形成产物的化学键放出的总能量。已知破坏1mol H-H键、1mol O=O键、1mol H-O键时分别需要吸收a kJ、b kJ、c kJ的能量。则2mol H2(g)和1mol O2(g)转化为2mol H2O(g)时放出的热量为
____________________kJ。
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,下图就是能够实现该转化的装置(其中电解质溶液为KOH溶液),被称为氢氧燃料电池.该电池的正极是___(填a或b),负极反应式为______________。
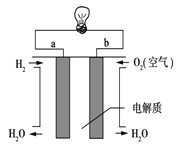
(4)若将右图中的氢氧燃料电池用固体金属氧化物陶瓷作电解质(能够传导O2-),已知正极上发生的电极反应式为:O2+4e-===2O2-则负极上发生的电极反应式为________;电子从________极(填a或b)流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应无关的是
A. 将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色
B. 将葡萄糖溶液加入新制Cu(OH)2悬浊液至沸腾,出现红色沉淀
C. 将H2C2O4溶液滴入酸性KMnO4溶液中,溶液紫红色褪去
D. 将SO2滴入盛有酚酞的NaOH溶液中,溶液红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硝酸中的一步重要反应是NH3在加热条件下催化氧化:4NH3+5O2![]() 4NO+6H2O这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下列说法中错误的是
4NO+6H2O这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下列说法中错误的是
A.使用催化剂可以加快反应速率,提高生产效率
B.适当提高O2的浓度可以提高NH3的转化率
C.升高温度,正反应速率增大、逆反应速率减小
D.NH3的转化率为最大值时,该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的不可能是
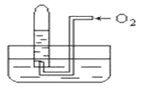
A.NO2一种气体B.O2与NO2的混和气体
C.NO与NO2的混和气体D.N2与NO2的混和气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8下列叙述正确的是
A. 该一元酸的电离方程式为HA = H++ A-
B. 该溶液中由水电离出的c(H+)=1×10-11mol·L-1
C. 该溶液中水的离子积常数为1×10-22
D. 将pH=11的NaOH溶液V1L与V2L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则混合溶液中有关离子浓度为c(Na+)>c(OH-)>c(A-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲苯与浓硫酸、浓硝酸在100℃时能获得不溶于水的淡黄色针状晶体,请写出反应方程式:__________。上述反应是加成反应还是取代反应?请判断并说明原因:__________________。
(2)Mg3N2是离子化合物,各原子均满足8电子稳定结构,写出Mg3N2的电子式:__________。
(3)在常压下,乙醇在水中的溶解度比溴乙烷在水中的溶解度大,主要原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PBAT(聚已二酸/对苯二甲酸丁二酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,它可由聚合物 PBA 和PBT 共聚制得,一种合成路线如下:
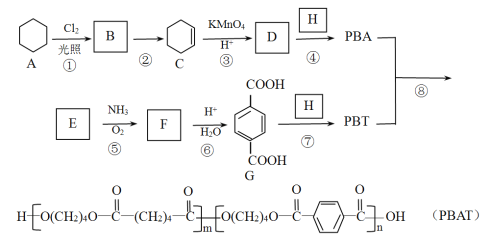
已知:R-CH3![]() R-CN
R-CN![]() R-COOH
R-COOH
R-CH=CH2![]() R-COOH+CO2
R-COOH+CO2
回答下列问题:
(1)B 的官能团名称为_____,D 的分子式为_____。
(2)①的反应类型为_____;反应②所需的试剂和条件是_____。
(3)H 的结构简式为_____。
(4)⑤的化学方程式为_____。
(5)M 与G 互为同系物,M 的相对分子质量比G 大 14;N 是 M 的同分异构体,写出同时满足以下条件的N 的结构简式:______________(写两种,不考虑立体异构)。
Ⅰ.既能与 FeCl3发生显色反应,又能发水解反应和银镜反应;
Ⅱ.与 NaOH 溶液反应时,1mol N 能消耗 4molNaOH;
Ⅲ.核磁共振氢谱有五组峰,峰面积比为 1:2:2:2:1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com