
【题目】下列各原子或离子的电子排布式错误的是( )
A. Al 1s22s22p63s23p1 B. S2- 1s22s22p63s23p4 C. Na+ 1s22s22p6 D. F 1s22s22p5
科目:高中化学 来源: 题型:
【题目】化学已经渗透到人类生活、生产的各个方面,下列说法正确的是
A. PM2.5是指微粒直径大于2.5μm的可吸入悬浮颗粒物
B. 用热的纯碱溶液可以清除炊具上残留的油污
C. 高纯度的硅单质广泛用于光导纤维,光导纤维遇强碱会造成“短路”
D. 明矾常用作净水剂,是因为它能够消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
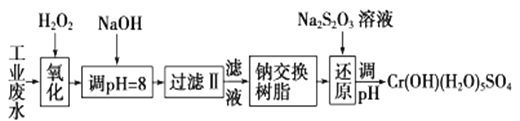
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.HNO3 B.Na2O2 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________(填ABCD序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________(填ABCD序号)。
A.Fe3+ B.Ca2+ C.Al3+ D.Mg2+
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
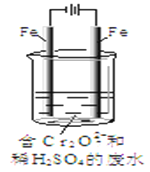
(3)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(4)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 体积相等的CO和N2质量一定相等
B. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6 N A
C. 用过量NaOH溶液吸收 CO2的离子方程式:OH-+CO2= HCO3-
D. NaHSO4溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀时溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学物质在实际生产、生活和科技等方面的应用正确的是( )
A. 我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B. 生产普通玻璃的主要原料有石灰石、石英和纯碱
C. 水晶项链和餐桌上的瓷盘都是硅酸盐制品
D. 玻璃上的漂亮花纹都依靠浓硫酸的腐蚀作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C三种可溶性化合物,它们的阳离子可能是Na+、Mg2+、Ag+,阴离子可能是NO3-、OH-、Cl-,分别取相同质量的三种化合物,溶解于水,配制相同体积的溶液, 其物质的量的浓度由大到小的顺序是A、B、C,则三种化合物化学式分别是:A______、B______、C_________________。
(2)有以下3种物质:①Na2CO3固体②Fe(OH)3胶体③硫化锑(Sb2S3)胶体
填空回答:
A.①既是钠盐又是碳酸盐,对该物质的分类方法是___________________________。
B.实验室制备②的化学方程式为_____________________________________。
C.橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,证明Sb2S3胶粒带_____电荷。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(l)ClO2的制备:(已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4)

①装置A中反应的化学方程式为_______________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为 a→_________(按气流方向,用小写字母表示)
③装置D的作用是_________。
(2)ClO2与 Na2S 的反应
将上述收集到的ClO2用 N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。

操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中, 加入Ba(OH)2溶液,振荡 | ①_________ | 有硫酸根离子生成 |
另取少量Ⅰ中溶液于试管乙中, 滴加品红溶液和盐酸 | 品红溶液不翅色 | ② 无_____生成 |
若在试管甲中继续加Ba(OH)2溶液至 过量,静置,取上层清液于试管丙③______ | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为__________。用于处理含硫废水时,ClO2相对于Cl2的优点是____________(任写2条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是 。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是 。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。

①X代表的物理量是 。
②判断L1、L2的大小关系,并简述理由: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com