
【题目】化学已经渗透到人类生活、生产的各个方面,下列说法正确的是
A. PM2.5是指微粒直径大于2.5μm的可吸入悬浮颗粒物
B. 用热的纯碱溶液可以清除炊具上残留的油污
C. 高纯度的硅单质广泛用于光导纤维,光导纤维遇强碱会造成“短路”
D. 明矾常用作净水剂,是因为它能够消毒杀菌
科目:高中化学 来源: 题型:
【题目】
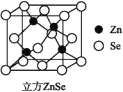
硒化锌是一种透明色半导体,也可作为红外光学材料,熔点是1 520 ℃。
(1)基态锌原子的价电子排布式是________。
(2)根据元素周期律,电负性Se________S,第一电离能Se________As(填“>”或“<”)。
(3)H2S分子的电子式:________,H2Se分子构型是_______,
其中硒原子的杂化轨道类型是________。
(4)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是________。
(5)晶体Zn为六方最密堆积,其配位数是________。
(6)ZnSe晶胞如图,假设阿伏加德罗常数的值为NA,则144 g ZnSe晶体中的晶胞数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法中正确的是
A. Fe3+与KSCN产生血红色沉淀
B. 铁与水蒸气在高温下的反应产物为Fe2O3和H2
C. 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤
D. 赤铁矿的主要成分是Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用或操作正确的是
A. 试剂瓶可以用于存放、溶解、稀释药
B. 烧杯、烧瓶、锥形瓶均可加垫石棉网加热品
C. 用容量瓶配制溶液时,加入蒸馏水需要用玻璃棒引流,加至刻度线
D. 用滴定管量取液体时,开始读数和最后读数均俯视,则量取的体积准确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是 、 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 ;其使用的最佳pH范围是 。

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
I.从废液中提纯并结晶出FeSO4·7H2O;
Ⅱ.将FeSO4·7H2O配制成溶液
Ⅲ.将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体;
V.煅烧FeCO3,得到Fe2O3固体
已知:NH4HCO3在热水中分解
(1)I中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是____。
(2)Ⅱ中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用______________。
(3)Ⅲ中,生成FeCO3的离子方程式是________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42-的操作是 __________。
(5)已知煅烧FeCO3的化学方程式是:____________。现煅烧464.0 kg FeCO3,得到316.8 kg产品。若产品中杂质只有Fe2O3,则该产品中Fe2O3的质量是____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各原子或离子的电子排布式错误的是( )
A. Al 1s22s22p63s23p1 B. S2- 1s22s22p63s23p4 C. Na+ 1s22s22p6 D. F 1s22s22p5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com