
【题目】容量瓶上需标有:①温度;②浓度;③容量;④压强;⑤刻度线;⑥酸式或碱式;六项中的
A. ①③⑤ B. ③⑤⑥ C. ①②④ D. ②④⑥
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁属,其目的是________。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为__________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是____________。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二只试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有_________(填离子符号),由此可以证明该氧化还原反应为_________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________;一段时间后,溶液中有大量气泡出现,随后有红褐色沉淀生成。产生气泡的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法不正确的是 ( )
A.乙烯可作水果的催熟剂
B.硅胶可作袋装食品的干燥剂
C.福尔马林可作食品的保鲜剂
D.氢氧化铝可作胃酸的中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源的开发利用与人类社会的可持续性发展息息相关。
I.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ·mol-1
CO(g)+1/2O2(g)=CO2(g)△H2=bkJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ·mol-1
则C的燃烧热________kJ·mol-1
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2C03与C02为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:
2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:
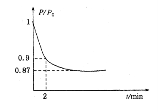
①反应达平衡的标志是(填字母代号)。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为。
③若提高N2的转化率可采取的措施有。
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大E.加入一定量的N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3·l0H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
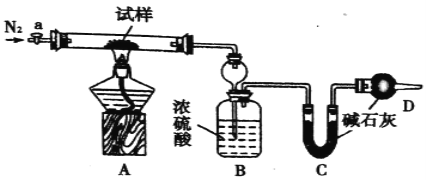
实验过程:
I.按图组装仪器,检查装置的气密性;
II.将m1 g试样放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3 g;
Ⅲ.关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为:________________;_______________。
(2)装置B的作用为_______________。装置C的作用为_______________。
(3)实验过程中通入N2的目的为__________。
(4)实验结束后发现装置A中硬质玻璃管右端有水珠,则w(NaHCO3)的计算式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.常温下,100g 46%乙醇水溶液中含有H原子数为12 NA
B.23g NA与足量O2反应,生成NA2O 和NA2O2 的混合物,转移的电子数为 NA
C.标准状况下,2.24 LCCl4 含有的共价键数为0.4 NA
D.1 molN2与4molH2反应生成的NH3分子数小于2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
PbCO3(s)+SO42-(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)上述反应的平衡常数表达式:K= 。
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在 溶液中PbSO4转化率较大,理由是 。
Ⅱ.Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3 (s)![]() Cr3+(aq)+3OH(aq)。
Cr3+(aq)+3OH(aq)。
常温下,Cr(OH)3的溶度积Ksp=1.0×1032,要使c(Cr3+)完全沉淀,溶液的pH应调至 。
Ⅲ.向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。溶度积为Ksp=c(Ag+)·c(Cl-)=1×10-10,试求:
(1)沉淀生成后溶液中c(Ag+)为________。
(2)沉淀生成后溶液的pH是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有A+、B3+、C3+ 三种金属阳离子的水溶液发生了如下一系列变化:
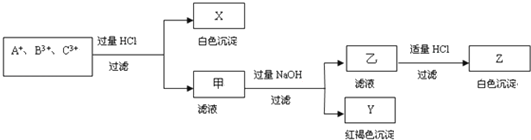
请通过分析回答(用化学符号填写):
(1)A+是______,B3+是____________,C3+是____________;
(2)X是____________,Y是____________,Z是____________;
(3)写出有关离子方程式:
①生成Y沉淀:_______________________;
②生成Z沉淀:_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
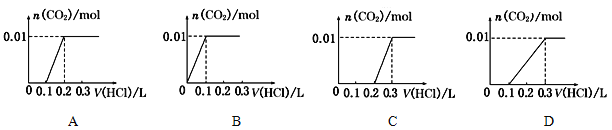
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com