
【题目】Ⅰ.工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
PbCO3(s)+SO42-(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)上述反应的平衡常数表达式:K= 。
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在 溶液中PbSO4转化率较大,理由是 。
Ⅱ.Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3 (s)![]() Cr3+(aq)+3OH(aq)。
Cr3+(aq)+3OH(aq)。
常温下,Cr(OH)3的溶度积Ksp=1.0×1032,要使c(Cr3+)完全沉淀,溶液的pH应调至 。
Ⅲ.向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。溶度积为Ksp=c(Ag+)·c(Cl-)=1×10-10,试求:
(1)沉淀生成后溶液中c(Ag+)为________。
(2)沉淀生成后溶液的pH是________。
【答案】Ⅰ.(1)![]()
(2)Na2CO3 相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO2-3)较大
Ⅱ.5Ⅲ.(1)1.0×10-7mol·L-1 (2)2
【解析】
试题分析:
Ⅰ.(1)反应平衡常数是用各反应物和生成物浓度计算表示,固体和纯液体的浓度是定值不出现在表达式中,平衡常数K=![]() ;
;
(2)在溶液中Na2CO3能完全电离生成CO32-,而HCO3-微弱电离生成CO32-,所以相同浓度的Na2CO3和NaHCO3溶液中,Na2CO3溶液中CO32-浓度大,PbSO4转化率较大;
Ⅱ.当离子浓度小于1.0×105mol·L-1时认为完全沉淀,根据Cr(OH)3的溶度积Ksp=c(Cr3+)×c3(OH)有,Ksp=1.0×1032=1.0×105×c3(OH),可得c(OH)=1.0×109mol·L-1,即pH=5;
Ⅲ.(1)AgNO3+HCl=AgCl↓+HNO3,n(AgNO3)=0.018mol/L×0.05L=9×10-4mol,
n(HCl)=0.02mol/L×0.05L=10×10-4mol,则剩余HCl为1×10-4mol:c(HCl)=1×10-3 mol/L,代入:Ksp =c(Ag+)c(Cl-)=1.0×10-10,得:c(Ag+)=1×10-7 mol/L;
(2)反应前后,溶液里H+的物质的量不变,则c(H+)=(0.05L×0.02mol/L)/0.1L=0.01 mol/L,则pH=2 。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,水中存在平衡:H2O![]() H++OH- ΔH>0,下列叙述正确的是
H++OH- ΔH>0,下列叙述正确的是
A.加入稀氨水,平衡逆向移动,c(OH-)降低,Kw不变
B.加入少量固体CuSO4,c (H+)增大,Kw不变
C.加入少量固体CH3COONa,平衡逆向移动,c(H+)降低,Kw不变
D.加热到90℃,Kw增大,溶液仍呈中性,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如下图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如下图所示,下列叙述正确的是
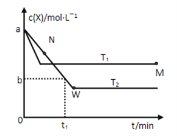
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)=![]() mol·L-1·min-1
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池不是把还原剂、氧化剂全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。下面有4种燃料电池的工作原理示意图,其中正极的反应产物为水的是

A.固体氧化物燃料电池
B.碱性燃料电池
C.质子交换膜燃料电池
D.熔融盐燃料电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃硝酸钾饱和溶液先升温至80℃,在恒温下蒸发部分溶剂至析出少量溶质,然后将溶液逐渐冷却至60℃.下列示意图中能正确表示整个过程中溶液浓度a%与时间t关系的是( )
A.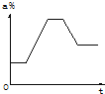 B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内有20多种微量元素,它们质量总和不到体重的千分之一,但是对人的健康却起着重要作用,下列各组元素全部是微量元素的是
A. Na、K、Cl、S、O
B. I、Fe、Zn、Cu
C. N、H、O、P、C
D. Ge、Ca、Cu、Mg、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
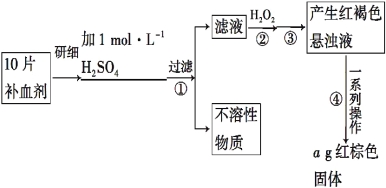
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加 ,该过程的现象为______________________。
(2)步骤②加入过量H2O2的目的是 _______________________。
(3)步骤④中反应的化学方程式是 _______________________。
(4)步骤④中一系列处理的操作步骤:过滤、________、灼烧、 、称量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com