
【题目】有机化合物甲与乙在一定条件下可反应生成丙:
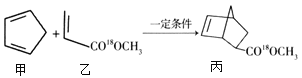
下列说法正确的是
A. 甲与乙生成丙的反应属于取代反应
B. 甲分子中所有原子共平面
C. 乙的一氯代物有2种
D. 丙在酸性条件下水解生成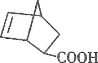 和CH318OH
和CH318OH
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】为了有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。
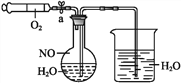
(1)打开止水夹,推动针筒活塞,使O2进入圆底烧瓶。关闭止水夹,首先观察到圆底烧瓶中的现象为_________,产生此现象的化学反应方程式为__。
(2)轻轻摇动圆底烧瓶,观察到圆底烧瓶中的现象为①___________;②________。产生此现象的化学反应方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。

(1)除如图装置所示的实验用品外,还需要的一件实验用品是______________。
(2)圆底烧瓶中所发生反应的离子方程式为___________。
(3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(4)利用该化学反应,试简述测定反应速率的其他方法:________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2 Na2S2O3=== Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(5)表中Vx=__________mL,T1、T2、T3的大小关系是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种高效除草剂,其合成路线流程图如下:
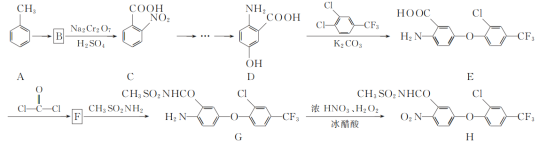
(1)E中含氧官能团名称为________和________。
(2)A→B的反应类型为________。
(3)写出同时满足下列条件的D的一种同分异构体的结构简式:________。
①不能发生水解反应,能与FeCl3溶液发生显色反应:
②分子中有4种不同化学环境的氢。
(4)F的分子式为C15H7ClF3NO4,写出F的结构简式:________。
(5)已知:—NH2与苯环相连时,易被氧化;—COOH与苯环相连时,再引入其他基团主要进入它的间位。请写出以A和D为原料制备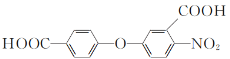 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过量排放含氮物质会污染大气或水体,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
Ⅰ.对NO与O2反应的研究。
(1)已知氮氧化物转化过程中的焓的变化如下图所示,写出 NO转化为NO2的热化学方程式__________。
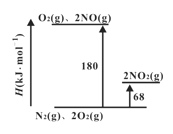
(2)2NO+O2![]() 2NO2的平衡常数表达式K=_______。其他条件不变,利用分子捕获器适当减少反应容器中NO2的含量,平衡常数K将_____(填“增大”、“减小”或“不变” )。
2NO2的平衡常数表达式K=_______。其他条件不变,利用分子捕获器适当减少反应容器中NO2的含量,平衡常数K将_____(填“增大”、“减小”或“不变” )。
(3)已知:2NO2(g)![]() N2O4(g) △H<0。在一定条件下,将2 mol NO和1 mol O2通入恒容密闭容器中进行反应,在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如下图所示。
N2O4(g) △H<0。在一定条件下,将2 mol NO和1 mol O2通入恒容密闭容器中进行反应,在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如下图所示。

①曲线c代表________的物质的量与温度的关系,x点对应的O2的转化率为________。
②根据上图可推测_________________。
A.2NO+O2![]() 2NO2的平衡常数:x点﹥y点
2NO2的平衡常数:x点﹥y点
B.y点时2NO+O2![]() 2NO2的反应速率:υ(正)﹤υ(逆)
2NO2的反应速率:υ(正)﹤υ(逆)
C.400~1200℃时,随着温度升高,N2O4体积分数不断增大
D.x点对应的NO的物质的量分数为4/11
Ⅱ.对废水中过量氨氮转化的研究。
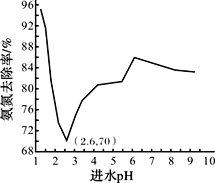
废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水,将其转化为无污染物质,不同进水pH对氨氮去除率的影响如图所示。
已知:ⅰ.HClO的氧化性比NaClO强;
ⅱ.NH3比NH4+更易被氧化。
(4)pH=1.25时,NaClO与NH4+反应生成N2等无污染物质,该反应的离子方程式______。
(5)进水pH为1.25~6.00范围内,氨氮去除率随pH升高发生图中变化的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
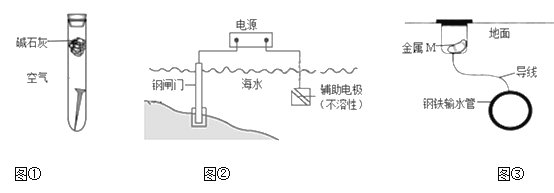
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
C. 图②,若断开电源,钢闸门将发生吸氧腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.由Na2CO3 + SiO2 ![]() Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
B.氢氟酸需要密封存放在橡胶塞的玻璃试剂瓶中
C.向硅酸钠溶液中加入盐酸产生白色沉淀,过量时沉淀溶解
D.瓷坩埚、氧化铝坩埚均不可作为融化NaOH固体的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g),生成2molHI(g)反应放出热量akJ,已知(a、b、c均大于零),下列说法正确的是( )
2HI(g),生成2molHI(g)反应放出热量akJ,已知(a、b、c均大于零),下列说法正确的是( )

A.反应物的总能量低于生成物的总能量
B.断开1molH—H键和1molI—I键所需能量大于断开2molH—I键所需能量
C.向密闭容器中加入2molH2和2molI2,充分反应后放出的热量等于2akJ
D.断开2molH—I键所需能量为(c+b+a)kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com