
某pH=1的X溶液中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶 液进行连续实验,实验过程及产物如下:
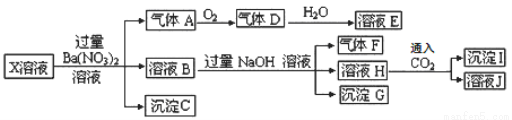
下列说法正确的是( )
A.气体A是NO2
B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是 A13+和C1―
D
【解析】
试题分析:A、pH=1的溶液是酸性溶液,酸性溶液中不可能大量存在CO32-、SO32-,加入过量硝酸钡溶液,则溶液中含有硝酸,有气体生成,说明该气体是硝酸的还原产物NO,所以A是NO气体,错误;B、原溶液中和硝酸发生氧化还原反应的只能是Fe2+,则原溶液中含有Fe2+,所得沉淀C是硫酸钡沉淀,则原溶液中存在SO42-,溶液B中加入过量氢氧化钠溶液由气体产生,则该气体F是氨气,原溶液中含有NH4+,溶液B中含有铁离子,所以沉淀H是氢氧化铁沉淀,通入二氧化碳气体产生沉淀,因为二氧化碳的量未知,所以产生的沉淀I可能是碳酸钡沉淀,则原溶液中Al3+不能确定,错误;C、溶液E是二氧化氮与水反应的产物硝酸,硝酸与气体F氨气可以反应生成硝酸铵,错误;D、根据以上分析,X中不能确定的离子是 A13+和C1―,正确,答案选D。
考点:考查溶液中离子的判断


科目:高中化学 来源:2015届河北省邯郸市高三第一次调研考试化学试卷(解析版) 题型:填空题
实验室需要配制0.5 mol·L-1的烧碱溶液500 mL,根据溶液配制的过程,回答下列问题:
(1)实验中除了托盘天平(带砝码)、药匙、量筒和玻璃棒外,还需要的其他玻璃仪器有:________________________________________;
(2)根据计算得知,所需NaOH固体的质量为________g;
(3)配制溶液的过程中,有以下操作。其中正确的是________(填代号)。
A.将氢氧化钠固体放在纸片上称量
B.在烧杯中溶解氢氧化钠固体后,立即将溶液倒入容量瓶中
C.将溶解氢氧化钠的烧杯用蒸馏水洗涤2~3次,并将洗涤液转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:填空题
(10分)
(1)制备氢氧化铁胶体的化学方程式为 。
(2)碳酸氢钠在水溶液中的电离方程式为 。
(3)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是 (填选项字母)。
HSO3-+OH-水解平衡的事实是 (填选项字母)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(4)现有可逆反应:2A(g)+2B(g) C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是 (填选项字母)。
C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是 (填选项字母)。
A.Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的百分组成相同
B.达到平衡时,途径Ⅱ所得混合气密度为途径Ⅰ所得混合气密度的2倍
C.达到平衡时,途径ⅡC的平衡浓度大于途径ⅠC的平衡浓度的2倍
(5)在恒容绝热(不与外界交换能量)条件下进行2A (g)+ B(g) 2C(g)+ D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系: 。
2C(g)+ D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系: 。
物质 | A | B | C | D |
起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:选择题
下列金属防腐的措施中,使用外加电流的阴极保护法的是
A.水中的钢闸门连接电源的负极B.金属护拦表面涂漆
C.枪炮表面涂上一层油D.地下钢管连接镁块
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:推断题
(12分)对溴甲苯是合成农药溴螨酯的重要原料。工业用液溴、甲苯与1-丙醇共热合成对溴甲苯和1-溴丙烷,其原子利用率很高。实验室模拟的合成流程和相关数据如下:已知:甲苯与溴在有水存在时能反应。
物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 |
沸点℃ | 110.8 | 97.2 | 71 |
物质 | 对溴甲苯 | 邻溴甲苯 | |
沸点℃ | 184.3 | 181.7 | |
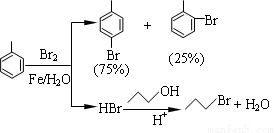
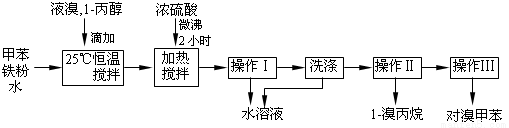
(1)液溴的颜色是__ __ __,实验室存放液溴时应密闭保存,同时需要在试剂瓶中加__ ___,以减少挥发。
(2)25℃恒温搅拌至溴的颜色完全褪去时完成甲苯的溴代反应。搅拌的目的是__________。加入水的作用是:易于控制温度;____________________。
(3)加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,加入浓硫酸的作用是___ ___,加热微沸2小时的目的是_______ _____。
(4)操作Ⅰ的名称是___________,洗涤操作应在_________(填写仪器名称)中进行。
(5)经以上分离操作后,粗对溴甲苯中还含有的最主要杂质为________(填写名称),使用操作Ⅱ分离出1-溴丙烷的原理是______________________________________。
(6)分离出的水溶液中含HBr、H2SO4和Fe3+离子,将水溶液稀释定容至1000mL,取20.00mL,加入几滴甲基橙作指示剂,用一定浓度的NaOH溶液滴定,测定出HBr的物质的量明显低于理论值,原因是_____________________;有同学认为无需加入指示剂,也能完成滴定,提出这一观点的理由是_______________________________。
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
x Mg+Mo3S4  Mgx Mo3S4 。下列说法错误的是( )
Mgx Mo3S4 。下列说法错误的是( )
A.放电时Mg2+向正极迁移
B.充电时阳极反应为:Mo3S42x-—2xe? =Mo3S4
C.充电时Mo3S4发生氧化反应
D.放电时负极反应为:xMg ? 2xe? = xMg2+
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
下列各项叙述中不正确的是( )
A.10 ℃ 时NaCl溶解度为35.7g,则此时饱和NaCl 溶液的质量分数小于35.7 %
B.向Na2CO3溶液中加入少量NaHCO3 固体,溶液pH 减小
C.50mL 1.0 mol·L-1盐酸与60 mL 1.0 mol·L-1盐酸分别跟50 mL 1.1 mol·L-1NaOH溶液进行反应,中和热数值不相等
D.一定条件下,向水中加入少量NaHSO4,可使水的电离程度减小
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.油脂在酸性或碱性条件下均可发生水解反应,且产物相同
B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
C.用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3
D.室温下,在水中的溶解度:丙三醇>苯酚>1?氯丁烷
查看答案和解析>>
科目:高中化学 来源:2015届江西省第一学期高三第一次月考化学(A卷)试卷(解析版) 题型:选择题
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如下图所示。则原H2SO4物质的量浓度是( )

A.1mol/L B.2mol/L C.3mol/L D.4mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com